
| 使用的 | 使用的 | |
| 甲 | NaOH固体 | 稀H2SO4 |
| 乙 | NaOH溶液 | 浓H2SO4 |
| 丙 | NaOH溶液 | 稀H2SO4 |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述数据变化,你可以得出的结论是 ;针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
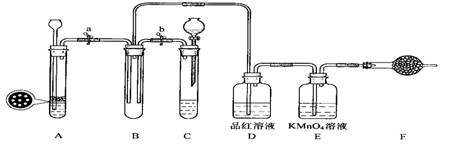
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。
回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:
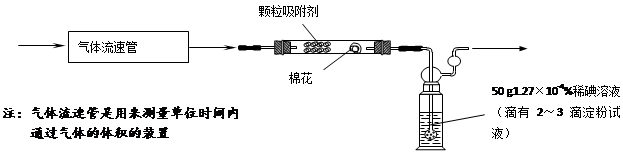
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100mL。
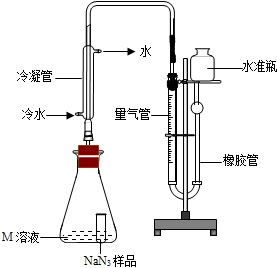
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J
查看答案和解析>>
科目:初中化学 来源:2010年重庆市江津区初三上学期末考试七校联考化学卷doc 题型:推断题
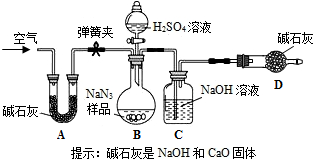
(15分)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
【制备研究】
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和
气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X
气体使用的试纸是湿润________。
【Na2CO3质量分数测定】
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体)。
(3)装置A的作用是_____。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。
|

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com