
【题目】为探究碱的性质,进行如下实验。
(1)如甲图所示,加入一定量的盐酸后,溶液红色褪去,反应过程中溶液温度是____________ (填“升高”或“降低”),反应的化学方程式为______________。
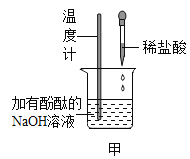
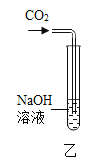
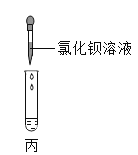
(2)乙图所示,在NaOH溶液中通入CO2,然后滴加氯化钡溶液(呈中性)如丙图。有白色沉淀产生。说明NaOH与CO2发生了反应,则乙中反应的化学方程式为____________________;丙中反应的化学方程式为______________。
(3)实验结束后废液处理。实验结束后将试管丙内所有物质全部倒入一大烧杯中,再将甲烧杯所得溶液缓慢加入,全部加入充分搅拌后测得溶液pH为3。在将甲烧杯所得溶液缓慢加入的过程中,大烧杯内可观察到的现象是_________________。最终大烧杯中除了酚外,还含有的溶质是_________________。最后,调节pH接近7,达到排放标准。
【答案】升高 ![]()
![]()
![]() 白色沉淀逐渐溶解, 有气泡产生 NaCl、BaCl2、HC1
白色沉淀逐渐溶解, 有气泡产生 NaCl、BaCl2、HC1
【解析】
(1)酸碱中和反应属于放热反应,所以温度升高;盐酸与氢氧化钠反应生成氯化钠和水,据此书写化学方程式;
故答案为:升高;![]() 。
。
(2)二氧化碳与氢氧化钠反应生成碳酸钠和水,据此书写化学方程式;生成的碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,据此书写化学方程式;
故答案为:![]() ;
;![]() 。
。
(3)根据最终得到溶液pH可知,溶液显酸性,说明盐酸过量,盐酸与碳酸钡可以反应生成氯化钡、水和二氧化碳,二氧化碳为气体会产生气泡,所以可以看到白色沉淀逐渐溶解,有气泡产生;甲中反应后有生成的氯化钠和剩余的盐酸,盐酸可与碳酸钡反应生成氯化钡,还可与氢氧化钠反应生成氯化钠,同时在丙中碳酸钠与氯化钡反应也生成氯化钠,所以此时溶质为生成的氯化钠、氯化钡,还有剩余的盐酸;
故答案为:NaCl、BaCl2、HC1。


科目:初中化学 来源: 题型:
【题目】硝酸钾在不同温度下的溶解度数据如下表所示:
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度(g/100g水) | 13.3 | 31.6 | 63.9 | 110 | 169 |
回答下列问题:
①硝酸钾的溶解度随温度升高而___(填“增大”或“减小”)。
②20℃时,将15克硝酸钾加入40克水中,充分搅拌,所得溶液为____(填“饱和”或“不饱和”)溶液;此时溶液的溶质质量分数为______(列出计算式)。
③某硝酸钾固体中混有少量氯化钠,分离提纯硝酸钾的操作是配成高温下的硝酸钾饱和溶液、_______、过滤、洗涤、干燥。
④甲是60℃的硝酸钾溶液,按下图所示进行操作。分析正确的是____(填序号)。
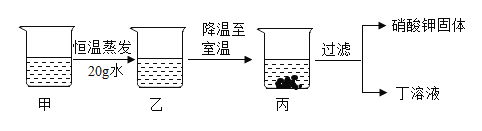
A 乙一定是不饱和溶液
B 丙和丁一定是饱和溶液
C 乙的溶质质量分数不一定比甲大
D 甲和丙的溶质质量分数有可能相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验课上,同学们利用澄清石灰水检验空气中的二氧化碳,实验中发现各组石灰水浑浊程度存在较大差异,于是设计实验探究影响石灰水浑浊程度的因素。
(进行实验)装置图如下所示。

实验1:取饱和澄清石灰水进行实验。
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
饱和澄清石灰水体积/mL | 2.0 | 1.5 | 1.0 | 0.5 |
缓慢通入2 L空气后的浑浊程度 | 不明显 | 明显 | 非常明显 | 明显 |
实验2:利用向饱和石灰水中添加蒸馏水来调节石灰水浓度进行实验(溶液浓度变化引起的溶液密度变化忽略不计)。
实验序号 | 2-1 | 2-2 | 2-3 | 2-4 |
饱和澄清石灰水体积/mL | 2.0 | 1.5 | 1.0 | 0.5 |
加入蒸馏水体积/mL | 0 | a | b | c |
缓慢通入3 L空气后的浑浊程度 | 非常明显 | 明显 | 不明显 | 无现象 |
(解释与结论)
(1)小试管中发生反应的化学方程式为____________。
(2)实验1的目的为____________。
(3)实验2中a、b、c三处数据,设计合理的是________。
A 0.5 0.5 0.5 B 0.5 1.0 1.5
C 1.0 1.5 2.0 D 1.0 2.0 3.0
(4)实验2的结论是________。
(反思与评价)
(5)通过对比实验1-1和2-1,可得出影响石灰水浑浊程度的另一因素是________,理由是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】乙炔(C2H2)是有机合成中的重要原料。以电石(CaC2)为原料制取乙炔,并对电石渣综合处理的生产流程如图所示:
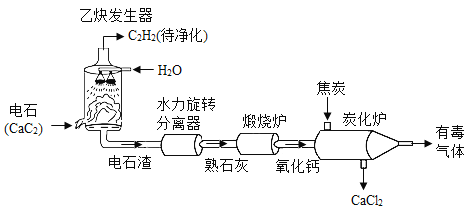
回答下列问题:
(1)乙炔发生器内发生反应的化学方程式为______。
(2)煅烧炉内氧化钙含量的变化有下图所示的结果,煅烧控制的最佳条件是______。

(3)碳化炉中,焦炭和氧化钙发生反应生成 CaC2 等,该反应中还原剂是______(写化学式),CaC2 中 C 元素化合价为______。碳化炉中的有毒气体不能直接排放,你对该有毒气体的处理建议是______。
(4)若将电石长期露置于空气中,会发生一系列变化,最终所得固体中一定含有的物质是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组同学将铜丝绕成螺旋状后,在酒精灯火焰上加热,铜丝变黑后,趁热插入疏松的氯化铵(NH4Cl)固体里,变黑的铜丝又变回紫红色。他们对此产生了兴趣,于是在老师的指导下进行如下探究:
(查阅资料)(1)氯化铵受热易分解,反应的化学方程式为:NH4Cl![]() NH3↑+HCl↑;
NH3↑+HCl↑;
(2)NH3+HCl=NH4Cl;
(3)无水硫酸铜为白色固体,遇水会变成蓝色。
(提出问题)使氧化铜还原为铜的是什么物质?
(作出猜想)猜想一:CO 猜想二:HCl 猜想三:NH3
小晶认为猜想一不合理,理由是_________。
(实验探究)兴趣小组同学按如下装置进行实验(夹持装置已省略):
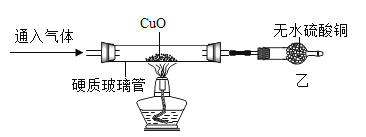
实验操作 | 实验现象 | 实验结论 |
将氯化氢气体和氨气分别通入装置,点燃酒精灯加热 | 通入氯化氢气体硬质玻璃管中无明显变化,通入氨气硬质玻璃管中观察到的现象是____。 | 猜想三成立 |
(反思与评价)
(1)通入氨气,观察到乙中固体变蓝,同时生成一种化学性质不活泼的气体。则氨气还原氧化铜的化学方程式为______。氨气有强烈的刺激性气味,对人体有害,则该装置存在的不足之处是________。
(2)小明认为实验室可用加热氯化铵的方法制取氨气,你认为该方法是否合理_________(填“合理”或“不合理”)。
(拓展延伸)“焊药”中含有氯化铵(NH4Cl),“焊药”的主要作用是清除焊接处金属表面生成的金属氧化物,确保焊接牢固。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】粗盐除氯化钠外,还含有氯化钙、氯化镁以及泥沙等杂质,如图是氯化钠和氯化镁两种物质的溶解度曲线,下列说法错误的是
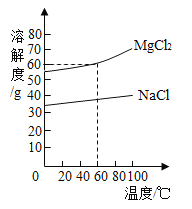
A.氯化钠和氯化镁都属于易溶物质
B.通常只宜采用蒸发结晶的方法从溶液中得到氯化钠晶体
C.60℃时氯化镁的饱和溶液中溶质的质量分数为37.5%
D.氯化镁的溶解度大于氯化钠的溶解度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化工厂用氢气和过量的氮气在一定条件下合成氨气(NH3),其微观过程如图所示。下列关于合成氨气的说法正确的是
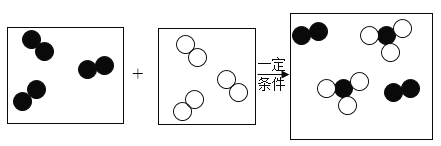
A.反应后生成了两种物质
B.反应前后氮元素和氢元素的化合价均没有改变
C.参加反应的氢气和氮气的分子个数比为3:1
D.反应前后分子和原子的种类和个数均没有变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢气燃烧能放出大量的热,且生成物只有水,“氢能”将是未来最理想的新能源,氢气的制备和储存成为研究的热点。
(1)最理想的制氢方法:在合适的催化剂作用下,利用太阳光使水分解。该制氢过程__(选填“吸收”或“放出”)能量,生成的氢气与氧气在相同条件下的体积之比为_______。
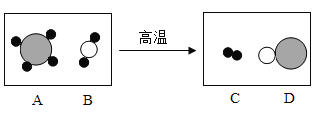
(2)下图是工业上制备氢气的微观示意图,其中不同的球代表不同的原子,则氢分子是___(填字母),该反应中A、D两物质的分子个数比是_____。
(3)某化学家根据“原子经济”的思想设计制备氢气的反应步骤如下图:
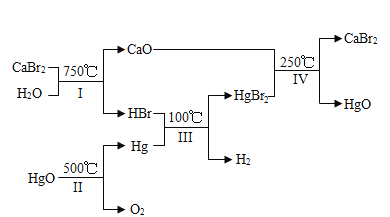
①图中Ⅳ反应属于复分解反应,写出该反应的化学方程式:_____。
②在整个流程中,可循环利用的物质有_______。
(4)我国稀土资源丰富,某种稀土储氢材料(用M表示)的储氢原理可表示为![]() 。 M的化学式为_______。
。 M的化学式为_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列课外实验得出的结论错误的是
A. 燃烧条件的实验------说明煤块不能燃烧
燃烧条件的实验------说明煤块不能燃烧
B. 石墨导电实验-------说明石墨具有导电性
石墨导电实验-------说明石墨具有导电性
C. 生成炭黑的实验--------说明石蜡中含有碳元素
生成炭黑的实验--------说明石蜡中含有碳元素
D. 探究鸡蛋壳的成分--------根据石灰水变浑浊推测鸡蛋壳里可能含有碳酸钙
探究鸡蛋壳的成分--------根据石灰水变浑浊推测鸡蛋壳里可能含有碳酸钙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com