
【题目】已知木炭粉(C)与某红棕色粉末(Fe2O3)在高温下反应生成二氧化碳(CO2)和铁(Fe)。某同学设计如下图装置测定红棕色粉末(Fe2O3)中氧元素的质量分数。
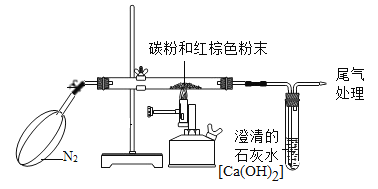
(1)实验前,要进行的操作是________________。
(2)实验开始时,要先通入纯净而干燥的N2,目的是________________。
(3)如果 3.2 g 该红棕色粉末与木炭粉充分反应,测得足量的澄清石灰水[Ca(OH)2]增重1.32g,反应生成的CO2中氧元素的质量是___________,该红棕色粉末中氧元素的质量分数为___________。
【答案】检查装置的气密性 将装置内的空气排尽 0.96g 30%
【解析】
(1)实验前,要进行的操作是:检查装置的气密性;
(2)空气中含有二氧化碳和氧气,可能会使生成物的质量增加,影响实验结果,故实验开始时,要先通入纯净而干燥的N2,目的是:将装置内的空气排尽;
(3)木炭粉(C)与某红棕色粉末(Fe2O3)在高温下反应生成二氧化碳(CO2)和铁(Fe),该反应的化学方程式为: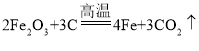 ,测得足量的澄清石灰水[Ca(OH)2]增重1.32g,说明生成二氧化碳的质量为1.32g,故反应生成的CO2中氧元素的质量是:
,测得足量的澄清石灰水[Ca(OH)2]增重1.32g,说明生成二氧化碳的质量为1.32g,故反应生成的CO2中氧元素的质量是:![]() ;
;
由化学方程式可知,三氧化二铁中的氧元素全部转化到了二氧化碳中,故该红棕色粉末中氧元素的质量分数为:![]() 。
。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:初中化学 来源: 题型:
【题目】右图是甲、乙两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是
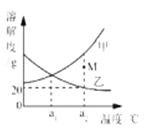
A.甲的溶解度大于乙的溶解度
B.a1℃时,甲、乙饱和溶液的温度升温至a2℃时,均有固体析出
C.a2℃时,M点对应的甲溶液不饱和
D.a2℃时,乙饱和溶液的质量分数为20%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2018年“中国水周”宣传主题为“实施国家节水行动,建设节水型社会”。
(1)如图是电解水的简易装置,电解水的反应符号表达式为_____。其中a是电源的_____(填“正”或“负”)极。若电解水共得到![]() 气体,则理论上可得到_____mL氧气。电解水实验说明水是由_____组成的。
气体,则理论上可得到_____mL氧气。电解水实验说明水是由_____组成的。
(2)自来水中含有较多的钙、镁离子,生活中常用的_____方法降低水的硬度。
(3)为响应号召,请你写出一条日常生活中节约用水的做法:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对比实验室实验探究的重要方法,下列对比实验设计能实现相应实验目的的是
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 探究CO2 与水发生了反应 | 探究水对铁钉锈蚀的影响 | 探究溶剂种类对物质溶解性的影响 | 探究MnO2是H2O2分解的催化剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室现有石灰石、稀盐酸、火柴、药匙、升降台、木条、棉花、镊子及以下仪器:
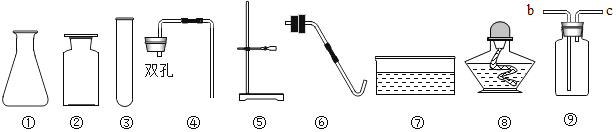
(1)若要制取CO2,应选择的仪器有①锥形瓶和_____(从①—⑧选填序号),还需补充的仪器是_____。(填名称)
(2)若利用一种药品按照下图装置制取氧气,发生的反应方程式为_____。
(3)用排水法收集氧气,当观察到导管口_____时,开始收集,气体逸出的原因是由于试管内温度升高且_____,使试管内压强大于外界大气压,在压强差的作用下,气体逸出。
(4)将制取氧气过程中和检验氧气的装置图在图中补充完整_____。
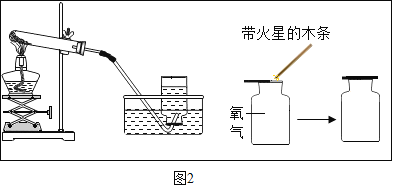
(5)用⑨装置收集O2时,气体应从_____。(“b”端或“c”端)通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现用浑浊的湖水制取纯水。将样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用如图所示装置将上层液体进行过滤,请问:
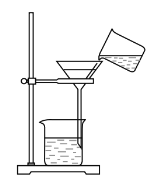
(1)图中还缺少的一种仪器是____________,其作用是____________;漏斗下端紧靠烧杯内壁是为了 ____________ 。
(2)操作过程中,发现过滤速度太慢,可能的原因有_________________。
(3)过滤后观察发现,滤液仍然浑浊。可能的原因有:①____________; ②____________;③______________。
(4)改进装置后过滤,得到了澄清透明的水,有人认为是纯水,你____________(填“同意”或“不同意”)他的看法,理由是____________。若要制取纯水,还需采用的净化方法是____________,该方法属于 ____________,(填“物理变化”或“化学变化”)。
(5)为了检验收集到的蒸馏水的硬度,加入____________ ,振荡,看到____________,说明其为软水。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下充分反应后,测得有关数据如下表所示:
物质 | M | N | Q | P |
反应前质量/g | 4 | 10 | 1 | 21 |
反应后质量 /g | 0 | 12 | 15 | 待测 |
已知M的相对分子质量为n,P的相对分子质量为2n,下列推理正确的是 。
A.反应后生成Q的质量为15g
B.反应中N与P发生改变的质量之比为1∶1
C.反应后P的质量为12g
D.该反应化学方程式中M与P的化学计量数之比为2∶3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学配制60g溶质质量分数为5%的NaCl溶液,准备了下列实验用品.回答下列问题:

(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④________(填步骤名称).
(2)配制过程还缺少的一种玻璃仪器是__________(填名称).
(3)计算所需NaCl的质量___g,称量时,NaCl应放在托盘天平的__盘(填左、右)上.
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用_______(填仪器名称)滴加蒸馏水至刻度线.
(5)若用俯视的方式量取水的体积,所配制溶液的溶质质量分数会______(填“偏大”、“偏小”或“无影响”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合水和溶液的相关知识,回答下列问题:
(1)对于沉淀、过滤、吸附、蒸馏等净化水的操作,相对净化程度较高的是________;
(2)水是化学实验中常用的试剂,下列各组物质能用水鉴别的是_____(填字母)
A 氢氧化钠和硝酸铵B 食盐和蔗糖C 高锰酸钾和碘
(3)欲配制100g溶质质量分数为10%的氯化钠溶液,完成此实验的正确操作顺序是_________
①溶解 ②把配好的溶液装入细口瓶 ③称量 ④计算 ⑤量取
(4)如图是甲、乙两种固体物质的溶解度曲线,回答下列问题:
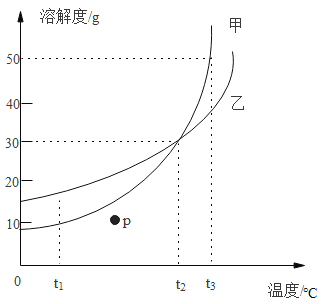
① P点处甲物质的溶液是 ______________ (填“饱和 / 不饱和”)
② t1℃时,甲物质的溶解度 __________ (填:>、<、=) 乙物质的溶解度
③ t3℃时,将60克的甲放入100克水中,充分搅拌,所得溶液的质量为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com