
| A. | 4:3:2 | B. | 4:2:1 | C. | 2:4:3 | D. | 2:3:2 |
分析 已知其中K+、SO42-、Cl-的个数比为9:2:3,设K+、SO42-、Cl-的个数分别为9x、2x、3x,溶液中存在电荷守恒,根据电荷守恒计算出硝酸根离子的个数,然后利用质量守恒定律分别计算出硫酸钾、氯化钾和硝酸钾的“分子”个数比.
解答 解:K+、SO42-、Cl-的个数比为9:2:3,设K+、SO42-、Cl-的个数分别为9x、2x、3x,
溶液中一定满足电荷守恒,则N(K+)=2N(SO42-)+N(Cl-)+N(NO3-),N(NO3-)=N(K+)-2N(SO42-)-N(Cl-)═9x-2×2x-3x=2x,
根据质量守恒定律可知,KNO3的“分子”个数为2x,KCl的“分子”个数为3x,则K2SO4的“分子”个数为2x,
所以溶液中K2SO4、KCl、KNO3的“分子”个数比=2x:3x:2x=2:3:2,
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确电荷守恒的含义为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.


科目:初中化学 来源: 题型:选择题
| A. | 氧气具有氧化性和可燃性 | |
| B. | 鱼、虾等能在水中生存,是由于氧气易溶于水 | |
| C. | 用带火星的木条检验氧气 | |
| D. | 物质在氧气中燃烧的反应一定是化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
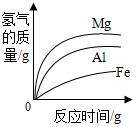
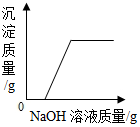
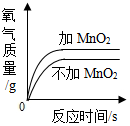
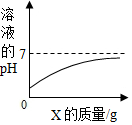
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 切洋葱时常流泪--分子在不断地运动 | |
| B. | 干冰升华--分子之间的间隙增大 | |
| C. | 蔗糖溶于水形成蔗糖溶液--分子是可以再分的 | |
| D. | 氧气与液氧都具有助燃性--分子能保持物质的化学性质 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
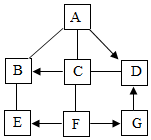 已知A~G是初中化学常见的物质,A、B、C、E、F属于不同类别的物质,G溶液呈 黄色,A与C反应产生白色沉淀(微溶物不列为沉淀),它们相互间发生反应或转化 的关系如图所示(“-”表示两种物质间能发生反应,“→”表示两种物质间的转化 关系,部分反应物、生成物和反应条件已经略去).
已知A~G是初中化学常见的物质,A、B、C、E、F属于不同类别的物质,G溶液呈 黄色,A与C反应产生白色沉淀(微溶物不列为沉淀),它们相互间发生反应或转化 的关系如图所示(“-”表示两种物质间能发生反应,“→”表示两种物质间的转化 关系,部分反应物、生成物和反应条件已经略去).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
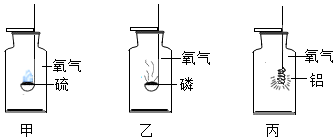
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com