
| 16 |
| 44 |
| 16 |
| 44 |


科目:初中化学 来源: 题型:
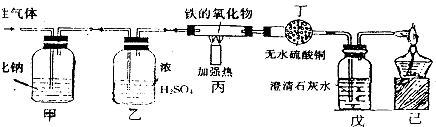
 通过实验现象和题给信息,按要求填空.为测定空气的成分按如图进行实验:
通过实验现象和题给信息,按要求填空.为测定空气的成分按如图进行实验:| 点燃 |
| 点燃 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 点燃 |
| 点燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量变质的过氧化钠粉末一支试管里,加入过量的水,然后用 带火星的木条 带火星的木条 检验该生成的气体. |
木条复燃 木条复燃 |
证明粉末中有Na2O2. |
| ②在①的剩余的溶液中加入足量的硝酸钡溶液,充分反应. | 产生白色沉淀 | 证明粉末中有 碳酸钠 碳酸钠 . |
| ③在①的剩余的溶液中加入足量的硫酸铜溶液. | 产生蓝色沉淀 产生蓝色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:
小刚为了解生活中常见的锌锰干电池,做了以下探究。

他打开一节废电池,观察到如下现象:①黑色碳棒完好无损;②电极周围充满黑色粉末;③里面有少量无色晶体;④金属外壳明显破损。
小刚查阅了资料:锌锰干电池的结构如右图所示,它以中心的碳棒(石墨)作正极,外围的锌筒作负极,锌筒与碳棒之间填满用氯化铵溶液(作电解质)拌湿的二氧化锰和石墨,石墨不参加化学反应,仅起导电作用。在电池的使用中,锌逐渐变成了氯化锌。
请你根据初中学习的知识和小刚的探究活动,完成下面各题:
(1)用碳棒作电极主要利用了石墨的___________性。
(2)干电池在使用过程中的能量转化是_____________________________________________。
(3)用简单的方法证明黑色粉末中含有石墨,写出操作步骤和实验现象:__________________
_______________________________________________________________________________。
(4)通过回收废旧锌锰干电池可得到的物质有___________、___________(至少2种)。
查看答案和解析>>
科目:初中化学 来源:2014年鲁教版九年级化学下册 11.1 化学与能源开发练习卷(解析版) 题型:填空题
小刚为了解生活中常见的锌锰干电池,做了以下探究。
他打开一节废电池,观察到如下现象:①黑色碳棒完好无损;②电极周围充满黑色粉末;③里面有少量无色晶体;④金属外壳明显破损。
小刚查阅了资料:锌锰干电池的结构如图所示,它以中心的碳棒(石墨)作正极,外围的锌筒作负极,锌筒与碳棒之间填满用氯化铵溶液(作电解质)拌湿的二氧化锰和石墨,石墨不参加化学反应,仅起导电作用。在电池的使用中,锌逐渐变成了氯化锌。请你根据初中学习的知识和小刚的探究活动,完成下面各题:

(1)用碳棒作电极主要利用了石墨的????????? 性。
(2)干电池在使用过程中的能量转化是??????????????????? 。
(3)用简单的方法证明黑色粉末中含有石墨,写出操作步骤和实验现象:????????????? ???????????? 。
(4)通过回收废旧锌锰干电池可得到的物质有??????? 、????????? (至少2种)。
查看答案和解析>>
科目:初中化学 来源:同步题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com