
【题目】某兴趣小组利用下列装置进行实验室制取和收集气体的实验,请回答:
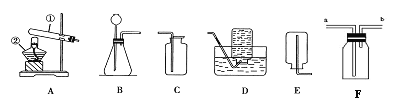
(1)写出标号仪器的名称:①__________ ②__________。
(2)若选择高锰酸钾制取氧气,该套装置有一处不足的地方,请你指出来__________;写出该反应的文字表达式是______________ 。
(3)如果进行铁丝燃烧的实验,选用的最佳收集装置是___(填字母标号),反应的文字表达式是______________ 。
(4)常温下,乙炔是一种无色气体,密度比空气略小,难溶于水。实验室常用碳化钙固体与食盐水反应来制取乙炔。现若制取并收集乙炔气体,应该选择的发生和收集装置是____________。(填字母标号)
(5)若用装置F收集二氧化碳,则验满的方法是______________________。
【答案】 试管 酒精灯 试管口没有放棉花 高锰酸钾![]() 锰酸钾+二氧化锰+氧气 D 铁+氧气
锰酸钾+二氧化锰+氧气 D 铁+氧气![]() 四氧化三铁 BD 将燃着的木条放在b处,木条熄灭,说明二氧化碳已满
四氧化三铁 BD 将燃着的木条放在b处,木条熄灭,说明二氧化碳已满
【解析】(1)根据常见仪器解答;(2)根据选择高锰酸钾制取氧气时,试管口应放一团棉花解答;高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气;(3)根据铁丝的燃烧实验需要在集气瓶中放少量水分析解答;铁和氧气在点燃的条件下生成四氧化三铁;(4)根据反应物的状态、反应条件及乙炔的密度和溶解性分析解答;(5)根据二氧化碳的密度比空气大,用F装置收集时应“长进短出”解答。
解:(1)写出标号仪器的名称:①试管,②酒精灯;(2)若选择高锰酸钾制取氧气,该套装置有一处不足的地方是:试管口没有放棉花;高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,反应的文字表达式为:高锰酸钾![]() 锰酸钾+二氧化锰+氧气;(3) 铁丝燃烧时需要在集气瓶中放少量水,故应选择排水法进行收集,因此选用的最佳收集装置是:D;铁和氧气在点燃的条件下生成四氧化三铁,反应的文字表达式是:铁+氧气
锰酸钾+二氧化锰+氧气;(3) 铁丝燃烧时需要在集气瓶中放少量水,故应选择排水法进行收集,因此选用的最佳收集装置是:D;铁和氧气在点燃的条件下生成四氧化三铁,反应的文字表达式是:铁+氧气![]() 四氧化三铁;(4) 实验室常用碳化钙固体与食盐水反应来制取乙炔,故应选择固液混合常温型发生装置,所以选B;又常温下,乙炔是一种无色气体,密度比空气略小,不适合排空气法收集。又乙炔难溶于水,故可用排水法收集,所以选D。现若制取并收集乙炔气体,应该选择的发生和收集装置是BD。(5)由于二氧化碳的密度比空气大,若用装置F收集二氧化碳,则验满的方法是:将燃着的木条放在b处,木条熄灭,说明二氧化碳已满。
四氧化三铁;(4) 实验室常用碳化钙固体与食盐水反应来制取乙炔,故应选择固液混合常温型发生装置,所以选B;又常温下,乙炔是一种无色气体,密度比空气略小,不适合排空气法收集。又乙炔难溶于水,故可用排水法收集,所以选D。现若制取并收集乙炔气体,应该选择的发生和收集装置是BD。(5)由于二氧化碳的密度比空气大,若用装置F收集二氧化碳,则验满的方法是:将燃着的木条放在b处,木条熄灭,说明二氧化碳已满。


科目:初中化学 来源: 题型:
【题目】关于“绿色化学”特点概述错误的是
A. 采用无毒无害的原料,生产出有利于人体健康、环保安全的产品
B. 充分利用绿色原料进行化工生产,产出绿颜色产品
C. 充分利用能源、资源,提高原子利用率、使原料的原子都成为产品
D. 在无毒、无害的条件下反应,减少向环境排放废物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关宏观现象的微观解释中说法错误的是( )
A.镁燃烧变成氧化镁时,镁原子的核电荷数发生了变化
B.氧气受热后体积变大,是因为分子受热后分子间间隔变大了
C.水电解生成氧气和氢气,是因为分子在化学变化中可以改变
D.未见饭菜就闻到饭菜的香味,说明分子在不停地运动
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验小组用下图所示装置来测定空气中氧气的含量,实验结果发现测得数值比实际空气中氧气的含量小,请你帮助他们找出实验误差的原因。(写出三条)

(1)________________
(2)________________
(3)________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】清凉甘甜的汽水中常含柠檬酸,已知柠檬酸的化学式为C6H8O7,请回答:
(1)柠檬酸中碳、氢、氧三种元素的原子个数比为_________.
(2)柠檬酸中碳、氢元素的质量比为_________.
(3)19.2g柠檬酸含碳元素_________g.(写出本题计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请认真回忆物质与其构成粒子之间的关系,回答下列问题:
(1)金属铁是由 _______构成的,氯化钾是由_________ 构成的,二氧化碳是由____构成的.
(2)原子得到或失去电子后形成离子.某粒子的结构示意图为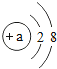
①当a=_____时,该粒子是原子,该原子位于元素周期表中第_____周期.
②当a=8时,该粒子是______(填“原子”、“阳离子”或“阴离子”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常温下,小明同学在练习“金属的化学性质”实验操作时,发现几支试管中冒出气泡的速率有快有慢,于是他与小芳同学一起合作进行如下探究。
【提出问题】金属与酸反应的快慢受哪些因素影响呢?
【猜想与假设】A.可能与酸的浓度有关;B.可能与金属的种类有关;C.可能与金属的形状有关。
【设计并实验】小明和小芳进行如下实验。
实验 编号 | 盐酸的 浓度 | 金属 (均取2 g) | 金属的 形状 | 收集50 mL 氢气所需要 的时间/s |
① | 10% | 镁 | 粉状 | 60 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 镁 | 片状 | 102 |
④ | 20% | 铁 | 片状 | 110 |
(1)实验时需将镁片和铁片进行打磨,其目的是______________________________________。
(2)写出铁与稀盐酸反应的化学方程式:________________________________。
【收集证据】
(3)要比较金属的种类对反应快慢的影响,应选择的实验编号是________。
【得出结论】通过上述四个实验,你得出的影响金属与酸反应的因素有________________________。
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应。实验测得该反应中产生气体的速率(v)与时间(t)的关系如图所示,你认为在t2~t3时间段内反应速率逐渐减慢的主要原因是________________________________________________________________________。
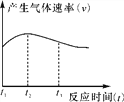
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文(改编自屠呦呦2015年12月7日瑞典演讲稿)。
很多中药古方都提到了青蒿入药抗疟疾,但当1971年开始从青蒿中提取有效成分时,结果却总是不理想。屠呦呦研究组反复研究中医古籍,其中“青蒿一握,以水两升渍,绞取汁,尽服之”激发了她的灵感。是不是高温下破坏了青蒿中抗疟的有效成分?屠呦呦立即改用乙醚在较低温度下进行提取,成功获得了抗疟有效单体的提纯物质,命名为青蒿素。
完成样品纯化后,通过元素分析、光谱测定、质谱及旋光分析等技术手段,测定相对分子质量为282,得出了青蒿素的化学式。但青蒿素的具体结构是什么样的呢?有机所得专家做了一个定性实验,加入碘化钾后,青蒿素溶液变黄了,说明青蒿素中含有过氧基团;而后专家又通过X射线衍射法等方法,最终确定了青蒿素是含有过氧基的新型倍半萜内酯。
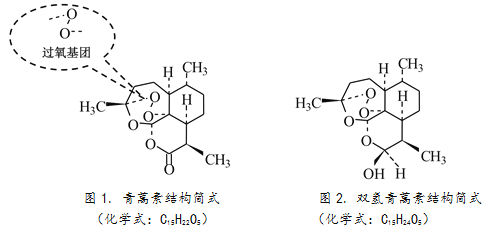
由于自然界中天然青蒿素的资源是有限的,接下来就要把自然界的分子通过人工合成制成药物。在这一过程中,研究组又有一项重大研究成果,获得了青蒿素的衍生物。衍生物之一是双氢青蒿素,它也具有抗疟的疗效,并且更加稳定,水溶性好,比青蒿素的疗效好10倍,进一步体现了青蒿素类药物“高效、速效、低毒”的特点。
依据文章内容,回答下列问题:
(1)从中国古代青蒿入药,到2004年青蒿素类药物被世界卫生组织列为对抗疟疾的首选药物,经历了漫长的历程。将下列三项针对青蒿素的研究按时间先后排序_________(填数字序号)。
①确定结构 ②分离提纯 ③人工合成
(2)青蒿素分子中碳、氢、氧原子个数比为___________。
(3)向无色的青蒿素溶液中加入碘化钾,实验现象为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com