
分析 (1)硫酸钠和碳酸钠的混合物中碳酸钠与硫酸反应放出二氧化碳气体,根据反应的化学方程式,利用反应消耗硫酸的质量可求得生成二氧化碳的质量;
(2)根据反应化学方程式,由反应消耗硫酸的质量可计算混合物中碳酸钠的质量,而求得原混合物中碳酸钠的质量分数;
(3)反应后所得溶液为硫酸钠溶液,可以提出问题:反应后溶液中溶质的质量分数.此时溶液中溶质硫酸钠由原混合物中硫酸钠及反应生成硫酸钠两部分组成,因此,需要利用化学方程式计算出反应生成硫酸钠的质量,然后再利用质量守恒定律计算出反应后溶液质量,即可解决反应后所得溶液中溶质的质量分数的计算.
解答 解:(1)由题意,设原混合物中碳酸钠的质量为x,生成Na2SO4的质量为y,生成CO2质量为z,
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 98 142 44
x 98g×10% y z
$\frac{106}{x}$=$\frac{98}{98g×10%}$=$\frac{142}{y}$=$\frac{44}{z}$
x=10.6g
y=14.2g
z=4.4g
(2)原混合物中碳酸钠的质量分数:$\frac{10.6g}{26.4g}$×100%=40.2%
(3)提出问题:反应后溶液中溶质的质量分数.
后溶液中Na2SO4的总质量为15.8g+14.2g=30 g
反应后溶液中溶质的质量分数为$\frac{30g}{26.4g+98g-4.4g}$×100%=25%
答:
(1)反应产生气体的质量4.4g;
(2)原混合物中碳酸钠的质量分数为40.2%;
(3)提出问题:反应后溶液中溶质的质量分数.(合理即可)
答案:反应后溶液中溶质的质量分数为25%.
点评 计算反应后溶液的溶质质量分数时,要注意原混合物中的硫酸钠因溶解也是反应后溶液中溶质的一部分.根据质量守恒定律,反应质量所得溶液质量=固体混合物的质量+所加入稀硫酸的质量-反应放出二氧化碳的质量.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
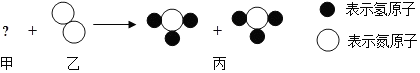
| A. | 物质甲的化学式为H6 | |
| B. | 化学反应中,分子是最小的微粒 | |
| C. | 该反应为化合反应 | |
| D. | 一个水分子中有一个氧原子和一个氢分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定呈碱性 | |
| B. | 酸碱中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| C. | 有一些金属与稀硫酸反应放出气体,所以与稀硫酸反应放出气体的物质是金属 | |
| D. | 碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com