
常温常压时,下列叙述不正确的是( )
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
B.pH=5的①NH4Cl溶液②CH3COOH溶液③稀盐酸溶液中c(H+)水:①>②>③
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.0.1 mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则b<a+l
【考点】盐类水解的应用.
【专题】盐类的水解专题.
【分析】A、等浓度的CH3COONa、NaOH和Na2CO3三种溶液PH大小NaOH>Na2CO3>CH3COONa;
B、氯化铵促进水的电离,醋酸和盐酸抑制水的电离;
C、醋酸是弱酸,平衡状态下的氢离子反应后,又继续电离出氢离子,混合溶液呈酸性;
D、醋酸是弱酸存在电离平衡,溶液浓度稀释10倍,溶液中氢离子浓度变化不是10倍;
【解答】解:A、等浓度的CH3COONa、NaOH和Na2CO3三种溶液PH大小NaOH>Na2CO3>CH3COONa,pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa),故A正确;
B、氯化铵促进水的电离,醋酸和盐酸抑制水的电离,pH=5的①NH4Cl溶液②CH3COOH溶液③稀盐酸溶液中c(H+)水:①>②=③,故B错误;
C、醋酸是弱酸,平衡状态下的氢离子反应后,又继续电离出氢离子,混合溶液呈酸性,滴入石蕊溶液呈红色,故C正确;
D、醋酸是弱酸存在电离平衡,溶液浓度稀释10倍,醋酸又电离出氢离子,溶液中氢离子浓度变化不是10倍,0.1 mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则b<a+l,故D正确;
故选B.
【点评】本题考查了弱电解质溶液酸碱性分析,电离平衡影响因素的理解应用,盐类水解和影响水的电离平衡因素的分析判断是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
人类只有一个地球,它是我们共同的家园。下列关于环境问题的说法正确的是
A.要防止“白色污染”,就不能使用塑料制品
B.积极开发使用新能源,减少化石燃料的使用,在生产和生活中提倡使用节能技术和节能用具
C.将钢铁厂的烟囱弄高些,消除尾气对环境的污染
D.废旧电池只要埋人土中,就能防止其对水源的污染
查看答案和解析>>
科目:初中化学 来源: 题型:
碳在地壳中的含量不高,但它的化合物数量众多,而且分布极广。
根据所学知识回答:

(1)图①为二氧化碳分子的示意图,由此获得的信息是 ▲ 。二氧化碳的相对分子质量为 ▲ ,其中碳元素的化合价为 ▲ 。
(2)图②、③是两种碳单质的微观结构模型,两单质性质不同的原因是 ▲ 。
(3)图④是一种新型的碳单质,它的一个分子中有60个碳原子,其化学式为 ▲ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
下列溶液中离子一定能够大量共存的是( )
A.加入Al能放出H2的溶液中:Cl﹣、SO42﹣、NO3﹣、Mg2+
B.能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42﹣、S2﹣、SO32﹣
C.c(H+):c(OH﹣)=1:1012的水溶液中:CO32﹣、Na+、NO3﹣、AlO2﹣
D.无色溶液中:K+、Na+、MnO4﹣、SO42﹣
查看答案和解析>>
科目:初中化学 来源: 题型:
工业上利用BaSO4制备BaCl2的工艺流程如下:
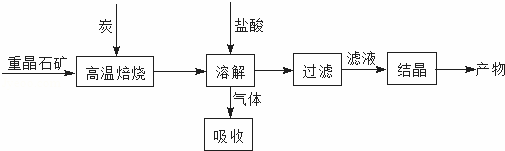
某活动小组的同学在实验室以重晶石(主要成分BaSO4)为原料,对上述工艺流程进行模拟实验.
(1)上述过程中,气体用过量NaOH溶液吸收得到Na2S.Na2S水溶液显碱性的原因是 (用离子方程式表示).
(2)已知有关反应的热化学方程式如下:
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=+571.2kJ/mol
4CO(g)+BaS(s)△H1=+571.2kJ/mol
C(s)+CO2(g) 2CO(g)△H2=+172.5kJ/mol
2CO(g)△H2=+172.5kJ/mol
则反应BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H3= kJ/mol
2CO2(g)+BaS(s)△H3= kJ/mol
(3)在高温焙烧重晶石过程中必须加入过量的炭,同时还要通入空气,其目的是 , .
查看答案和解析>>
科目:初中化学 来源: 题型:
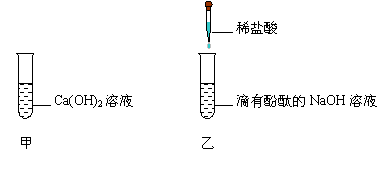 为了探究中和反应,甲、乙两名同学分别进行以下实验。
为了探究中和反应,甲、乙两名同学分别进行以下实验。

(1)甲同学向装有少量Ca(OH)2溶液的试管中倒入一定量的稀盐酸,然后滴加几滴酚酞
试液,发现酚酞不变色,此现象 (填“能”或“不能”)说明盐酸与氢氧
化钙发生了反应。
(2)乙同学向滴有酚酞的NaOH溶液中逐滴加入稀盐酸,边滴加边振荡,“振荡”的目
的是 ,在滴加过程中,乙同学意外发现有气泡产生,通过思考
认为该氢氧化钠溶液已变质,变质的原因是 (用化学方程式表示)。
(3)乙同学为了检验该氢氧化钠溶液的变质程度,设计实验方案并得出结论。
| 实验操作 | 实验现象 | 实验结论 |
| 取样于试管中,先滴加 , 再滴加 。 |
| 氢氧化钠溶液 部分变质 |
(4)实验结束后,甲、乙两名同学将三支试管中的废液倒入同一洁净烧杯中,得到无色
澄清溶液,分析所得溶液中溶质的成分为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com