
���� ��1�����������غ㶨�ɼ������ɶ�����̼��������
��2�����ݻ�ѧ����ʽ�����ɶ�����̼���������м��㣮
��� �⣺��1�����ɶ�����̼������Ϊ��100g+12g-107.6g=4.4g��
��2����μӷ�Ӧ��̼���Ƶ�����Ϊx
2HCl+Na2CO3=2NaCl+H2O+CO2��
106 44
x 4.4g
$\frac{106}{44}$=$\frac{x}{4.4g}$
x=10.6g
������Ʒ�д��������������$\frac{10.6g}{12g}$��100%=88.3%��
�ʴ�Ϊ����1��4.4��
��2����Ʒ�д��������������88.3%��
���� ������Ҫ�����˻�ѧ����ʽ�ļ��㣬�ѶȲ���ע�����Ĺ淶�Ժ�ȷ�ԣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ý�����þ��ͭ���� | B�� | ������ˮ����������ʯ�� | ||
| C�� | �л���Ҵ���������̼�������� | D�� | ̼���ʣ����ʯ��ʯī��C60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Һ�У�Na+��Cu2+��OH- | B�� | ��ϡ�����У�Ba2+��CO32-��Zn2+ | ||
| C�� | ���Ȼ�����Һ�У�K+��Ca2+��NO3- | D�� | ������������Һ�У�H+��Mg2+��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  Ϩ��ƾ��� | B�� |  �㵹Һ�� | C�� |  �����ᴿ | D�� |  �μ�Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X��Y��Z | B�� | Y��Z��X | C�� | Y��X��Z | D�� | Z��Y��X |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
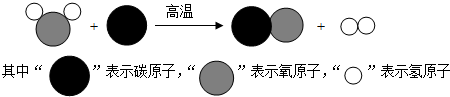
| A�� | ͼ�� ������������ ������������ | |
| B�� | �÷�Ӧ����Ϊ�û���Ӧ | |
| C�� | ��Ӧǰ��ԭ�ӵ��������Ŀ���ֲ��� | |
| D�� | һ�� ��һ����ԭ�Ӻ�һ������ӹ��� ��һ����ԭ�Ӻ�һ������ӹ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com