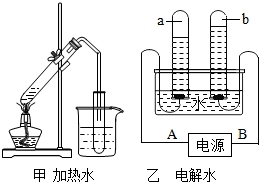
解答:解:(1)由A、B装置实验过程中水的变化可知,在A中主要是水的状态发生好了变化,在B中水发生分解生成了氢气和氧气.所以,从分子原子的知识分析是:A中水分子没有改变,B中水分子改变;
(2)在图乙电解水的装置中,由于a试管收集的气体较多,是氢气,则导线A连接的是电源的负极,小明推测“a试管内产生的是氢气,b试管内产生的是氧气.”这属于科学探究中的猜想与假设,还需要设计并进行实验
(3)由上述分析可知,a试管收集的气体是氢气具有可燃性,要验证试管a中产生的气体可用燃着的木条检验,现象是气体燃烧产生淡蓝色火焰,说明a气体具有的性质是可燃性.由于电解水时生成的氢气和氧气的体积比是2:1,若试管a内集到的气体为5mL,则b试管收集到的气体为2、5mL.构成a试管中气体微粒是氢分子,分子的模型可表示为B;
(4)在乙装置中水在通电的通电的条件下生成了氢气和氧气,发生的化学反应文字表达式是:水
氧气+氢气,该反应由一种物质生成了两种物质,属于分解反应,这一反应是将电能转化成化学能.根据能量守恒原理,该实验中生成的氢气和氧气含有的化学能之和比反应前水所含的化学能高.因为水要通电才可以发生反应.
(5)在乙装置实验中,变化的微粒是水分子,符号为H
2O,不变的微粒是氢原子和氧原子,符号为:H、O;生成新的微粒是氢分子和氧分子,符号为:H
2、O
2.由此我们可知分子、原子的根本区别是在:化学变化中分子可以改变,原子不改变.
(6)A.水是由氢元素和氧元素组成的,故A错误;
B.分子在化学变化中可以再分,故B错误;
C.分子在化学变化中可以改变,故C正确;
D.生成氧气中氧分子的化学性质与空气中氧分子,是同种的分子,化学性质相同.故D正确;
(7)水通电生成未来最理想的能源-氢气,因为燃烧易发生爆炸,因此点燃前必须验纯,这一过程发生反应是氢气燃烧生成了水,反应的文字表达式是:氢气+氧气
水.
故答为:(1)A中水分子没有改变,B中水分子改变;(2)负,B,C;(3)燃着的木条,气体燃烧产生淡蓝色火焰,可燃性,2、5毫升,B;(4)水
氧气+氢气,分解反应,电能转化为化学能,高,水要通电才可以发生反应;(5)H
2O,H、O,H
2,O
2,在化学变化中分子可以改变,原子不改变;(6)C,D;(7)检验纯度,氢气+氧气
水.

 观察A、B 两幅图回答以下问题:
观察A、B 两幅图回答以下问题: 表示,氧原子模型用
表示,氧原子模型用 表示,则构成a试管中气体微粒的模型可表示为
表示,则构成a试管中气体微粒的模型可表示为 B.
B. 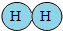 C.
C.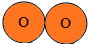 D.
D.


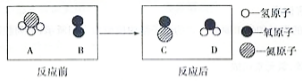 在催化剂并加热的条件下,A(氧气)与B反应生成C(一氧化氮)和D.反应前后分子变化的微观示意图如图所示:
在催化剂并加热的条件下,A(氧气)与B反应生成C(一氧化氮)和D.反应前后分子变化的微观示意图如图所示: