
在A.铁B.铜C.氢氧化钾溶液D.大理石E.硝酸钾溶液F.硫酸铜溶液等
6种物质中,(1)能够与盐酸发生置换反应的物质是__________;
(2)能够与盐酸发生复分解反应并产生气体的物质是______;
(3)给出的6种物质中,彼此间能发生复分解反应产生蓝色沉淀的两种物质是______和______.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:阅读理解
 某校化学兴趣小组对金属活动性顺序等知识进行了研究.
某校化学兴趣小组对金属活动性顺序等知识进行了研究.

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
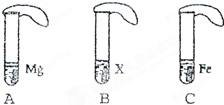 在相同条件下,金属与酸发生反应的速率越快,金属的活动性就越强.为了探究金属Mg、Fe和某金属X等三种金属的活动性顺序,研究性学习小组设计了如下实验(如图).
在相同条件下,金属与酸发生反应的速率越快,金属的活动性就越强.为了探究金属Mg、Fe和某金属X等三种金属的活动性顺序,研究性学习小组设计了如下实验(如图).| 编号 | A | B | C |
| 现象 | 金属表面有大量气泡冒出,气球膨胀速度快 | 金属表现无气泡冒出,气球不膨胀 | 金属表面有气泡冒出,气球膨胀速度较慢 |
查看答案和解析>>
科目:初中化学 来源:化学教研室 题型:058
在A.铁B.铜C.氢氧化钾溶液D.大理石E.硝酸钾溶液F.硫酸铜溶液等
6种物质中,(1)能够与盐酸发生置换反应的物质是__________;
(2)能够与盐酸发生复分解反应并产生气体的物质是______;
(3)给出的6种物质中,彼此间能发生复分解反应产生蓝色沉淀的两种物质是______和______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com