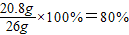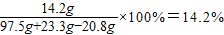(2002?天津)将26g不纯的氯化钡粉末(杂质不溶于水,也不参加反应)加入到一定量的硫酸钠溶液中恰好完全反应,得到23.3g沉淀和溶质质量分数为12%的溶液.请计算:
(1)不纯的氯化钡粉末中氯化钡的质量分数;
(2)硫酸钠溶液中溶质的质量分数.
【答案】
分析:(1)根据反应的化学方程式,由生成沉淀的质量计算出26g不纯的氯化钡粉末中氯化钡的质量,再利用质量分数计算公式求出不纯的氯化钡粉末中氯化钡的质量分数;
(2)要解决硫酸钠溶液中溶质的质量分数,需要根据反应计算出参加反应的硫酸钠的质量,还需要计算出反应后所得溶液的质量再使用质量守恒定律计算出硫酸钠溶液的质量,最后使用溶质的质量分数计算公式求出硫酸钠溶液中溶质的质量分数.
解答:解:设不纯的氯化钡粉末中含氯化钡的质量为x,参加反应的硫酸钠的质量为y,生成氯化钠的质量为z
BaCl
2+Na
2SO
4═BaSO
4↓+2NaCl
208 142 233 117
x y 23.3g z
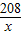
=
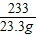
x=20.8g
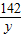
=
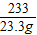
y=14.2g
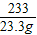
=
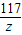
z=11.7g
不纯的氯化钡粉末中含氯化钡的质量分数=
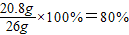
所得氯化钠溶液的质量=11.7g÷12%=97.5g
硫酸钠溶液中溶质的质量分数=
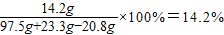
答:(1)不纯的氯化钡粉末中氯化钡的质量分数80%;(2)硫酸钠溶液中溶质的质量分数14.2%.
点评:根据质量守恒定律计算反应物硫酸钠溶液的质量,硫酸钠溶液的质量=反应后溶液质量+生成沉淀的质量-参加反应的氯化钡的质量.

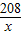 =
=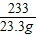 x=20.8g
x=20.8g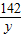 =
=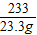 y=14.2g
y=14.2g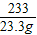 =
=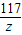 z=11.7g
z=11.7g