
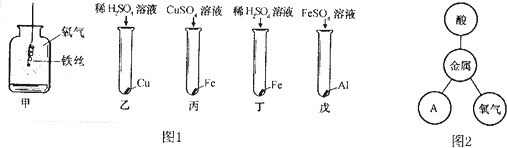

分析 (1)铁在氧气中燃烧生成四氧化三铁;铁和硫酸铜反应生成硫酸亚铁和铜;根据实验现象可以判断金属的活动性顺序;
(2)高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳;
(3)金属具有良好的导电性、导热性.根据碱式碳酸铜能与硫酸反应生成硫酸铜、水和二氧化碳,硫酸铜能与锌反应生成硫酸锌和铜,溶液B是硫酸锌,固体D能与硫酸反应生成无色气体E,则D中除了含有铜,还含有锌,然后进行验证即可.
解答 解:(1))①图1甲中反应现象是铁丝剧烈燃烧,火星四射,生成黑色固体,放出热量;丙中反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
故填:铁丝剧烈燃烧,火星四射,生成黑色固体,放出热量;Fe+CuSO4═FeSO4+Cu.
②比较活泼的金属能够把较不活泼的金属从它的盐溶液中置换出来,图1只有乙中不反应,能得出三种金属活动性及它们和氢元素的位置关系,由强到弱的顺序是铝、铁、氢、铜.故填:Al>Fe>Cu.
③依据图1完成金属性质网络,图2中的A属于盐.
故填:盐.
(2)用一氧化碳还原赤铁矿冶铁反应的化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.故填:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)①下列金属制品的用途,利用其导电性的是B,即铜用作导线,是因为铜具有良好的导电性.故填:B.
②合金性能优于单一金属,因而被广泛应用.焊锡(主要含锡、铅)与其组成金属相比具有熔点低的特性,可用于焊接电子元件.故填:熔点低;
③碱式碳酸铜与硫酸反应生成硫酸铜、水、二氧化碳,所以蓝色溶液B是硫酸铜溶液,E与硫酸铜溶液反应生成硫酸锌,所以E是锌,铁与硫酸铜反应生成了铜和硫酸锌,得到的固体D与硫酸反应后有气体生成,说明有锌剩余,锌与硫酸铜反应生成了铜,固体D中含有锌和铜.
故答案为:a.Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑;b.锌、铜.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因.
小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
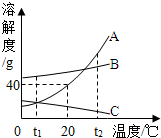 如图为A、B、C三种物质的溶解度曲线,据图回答:
如图为A、B、C三种物质的溶解度曲线,据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铝丝浸入硫酸铜溶液中,溶液由蓝色逐渐变成无色 | |
| B. | 将空气中燃着的硫粉伸入氧气瓶中,火焰由黄色变成蓝紫色 | |
| C. | 铁钉放入稀盐酸中,溶液由无色逐渐变成浅绿色 | |
| D. | 铜丝浸入硝酸银溶液中,铜丝表面覆盖一层银白色的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com