
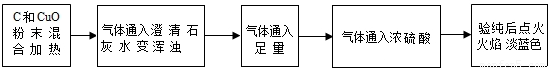
| 实验操作 | 实验现象 | 实验结论 |
| 取7.2克红色固体,置于烧杯中,向其中加入足量的稀硫酸,充分搅拌,静置 | 无明显现象 | (1)证明红色固体是 |
| (2) (填现象) | (3)证明红色固体肯定含 | |
| 取上述反应液过滤、洗涤、干燥和称量,得固体6.8克 | / | (4)Cu2O有 克 |
 =
=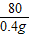
| 实验操作 | 实验现象 | 实验结论 |
| 取7.2克红色固体,置于烧杯中,向其中加入足量的稀硫酸,充分搅拌,静置 | 无明显现象 | (1)证明红色固体是 Cu |
| (2)溶液变成蓝色 (填现象) | (3)证明红色固体肯定含 Cu2O | |
| 取上述反应液过滤、洗涤、干燥和称量,得固体6.8克 | / | (4)Cu2O有 0.72克 |


科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| 编号 | 称量物 | 反应前 | 反映后 |
| 一 | 硬质玻璃管及所盛固体总质量 | 76.2g | 73.8g |
| 二 | C装置总质量 | 153.7g | 160.3g |
| ||
| 160 |
| 132 |
| X |
| 6.6g |
| 8g |
| 10g |
| ||
| 160 |
| 132 |
| X |
| 6.6g |
| 8g |
| 10g |
查看答案和解析>>
科目:初中化学 来源: 题型:
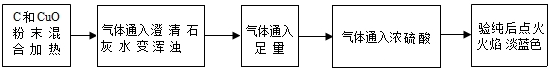
| 实验操作 | 实验现象 | 实验结论 |
| 取7.2克红色固体,置于烧杯中,向其中加入足量的稀硫酸,充分搅拌,静置 | 无明显现象 | (1)证明红色固体是 Cu Cu |
| (2) 溶液变成蓝色 溶液变成蓝色 (填现象) |
(3)证明红色固体肯定含 Cu2O Cu2O | |
| 取上述反应液过滤、洗涤、干燥和称量,得固体6.8克 | / | (4)Cu2O有 0.72 0.72 克 |
查看答案和解析>>
科目:初中化学 来源: 题型:
2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁的实验作了绿色化改进后制取单质铁(如下图,K1、K2是活塞):
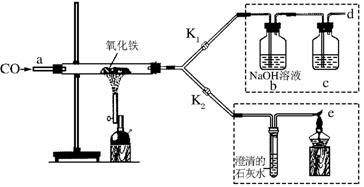
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。
①这是关于气体的实验,实验前必须对装置进行________________。
②CO还原Fe2O3的化学方程式为:____________________________________。
③在e处点燃气体的目的是_________________________________________________。
(2)关闭K2,开启K1,可以将d口出来的气体再从a通入装置而循环使用。
①c瓶中应装______(填字母)。
A.澄清石灰水 B.水
C.石蕊溶液 D.浓硫酸
②反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,必要的实验操作为转移、______、结晶。
③该实验这样改进的主要优点是____________________________________。
查看答案和解析>>
科目:初中化学 来源:2009-2010学年江苏省南通市九年级(上)期末化学试卷(解析版) 题型:解答题
| 实 验 操 作 | 现 象 | 分析 |
| 取7.2g红色固体,置于烧杯中,向其中加入足量稀硫酸,充分搅拌,静置. | 若无变化现象. | 证明红色固体是______. |
| 若有______. | 证明红色固体肯定含有______. | |
| 取上述反应后的溶液过滤、洗涤、干燥和称量,得固体6.8g. | -------------- | 确认红色固体是______. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com