
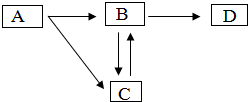
分析 根据题目中的信息:“B能与人体血液内的血红蛋白结合从而使人中毒”,则推测B为一氧化碳;“A和D均为黑色物质”,结合图框,则推测A为碳,C为二氧化碳,D为铁,代入检验,符合题意.
解答 解:
根据题目中的信息:“B能与人体血液内的血红蛋白结合从而使人中毒”,则推测B为一氧化碳;“A和D均为黑色物质”,结合图框,则推测A为碳,C为二氧化碳,D为铁,代入检验,符合题意.
(1)由碳原子的结构示意图可知碳原子的质子数是6,元素的最外层电子数决定了元素的性质,常温下碳的化学性质不活泼是由于碳原子的最外层电子数是4不易得失电子导致的;
(2)在加热的条件下,一氧化碳会与氧化铁发生还原反应,把铁从其氧化物中还原出来,生成铁与二氧化碳,故B与D反应的化学方程式是Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,一氧化碳具有还原性,做还原剂.
(3)“A转化成C”,即碳燃烧生成二氧化碳,属于化合反应.
(4)根据分析,B与C为一氧化碳、二氧化碳,故其化学性质不同是因为它们的分子构成不同.
故答案为:
(1)碳原子的最外层电子数是4不易得失电子.(2)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,CO.(3)化合.(4)分子构成.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:初中化学 来源: 题型:填空题
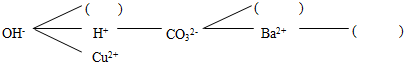
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.| 实 验 操 作 | 预期现象 | 结 论 |
| 向固体中加入足量的稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3,而不是NaOH |
| 向固体中加入足量的稀盐酸 | 没有气泡产生 | 固体产物是NaOH,而不是Na2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气用于金属切割-------氧气具有可燃性 | |
| B. | 二氧化碳用来灭火------二氧化碳本身不燃烧也不支持燃烧,且密度比空气大 | |
| C. | 在铁制水龙头表面镀铬------为了美观 | |
| D. | 水电解产生氢气和氧气------化学变化中原子是可以再分的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酸中一定含有氢元素 | B. | 碱中一定含有氢元素和氧元素 | ||
| C. | 盐中可能含有氧元素 | D. | 含氧元素的化合物一定是氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com