
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:初中化学 来源: 题型:阅读理解
 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |

| 工业纯碱标准(Na 2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2013年浙江省绍兴市高级中等学校招生考试化学 题型:043
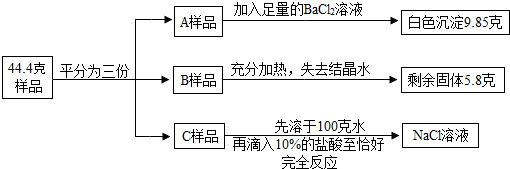
将质量为44.4克含有少量NaCl的纯碱晶体(Na2CO3·nH2O)样品,平均分成A、B、C三份,进行如图实验(Na2CO3受热不分解).
(1)将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是________.
(2)A样品中与BaCl2溶液反应的Na2CO3的质量是________克.
(3)B样品中含有结晶水的质量是________克.
(4)化学式Na2CO3·nH2O中n是多少?
(5)对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少?(精确到0.01%)
查看答案和解析>>
科目:初中化学 来源: 题型:
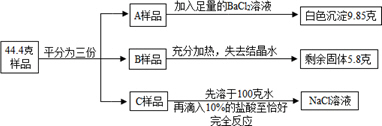
将质量为44.4克含有少量NaCl的纯碱晶体(Na2CO3·nH2O)样品,平均分成A、B、C三份,进行如图实验(Na2CO3受热不分解)。
(1) 将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是_____。
 (2) A样品中与BaCl2溶液反应的Na2CO3的质量是_____克。
(2) A样品中与BaCl2溶液反应的Na2CO3的质量是_____克。
(3) B样品中含有结晶水的质量是__________克。
(4) 化学式Na2CO3·nH2O中n是多少?
(5) 对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少?(精确到0.01%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com