
分析 (1)根据化学变化的实质解答;
(2)根据物质的分类类别解答;
(3)根据青霉素的组成解答;
(4)根据化合物中正负化合价代数和为零的原则解答;
(5)根据稀有气体化学性质稳定解答.
解答 解:(1)镁在通电之后与空气中的氧气反应,生成了新物质,故属于化学变化;
(2)氧化铝和二氧化硅均属于氧化物,故属于化合物;
(3)磷肥是含有磷元素的化合物,
(4)青霉素的化学式C16H18N2O4S;可知青霉素由5种元素组成;
(5)次氯酸钠(NaClO)中钠为+1价,氧为-2价,设氯的化合价为x,则:(+1)+x+(-2)=0,故x=+1;
(6)氩气可作保护气的原因是性质稳定,不易发生化学反应.
故答案为:(1)化学;(2)BC;(3)5;(4)+1;(5)化学性质稳定.
点评 本题考查知识点较多,内容繁琐,但基础较强,需熟练掌握初中化学中所学的基础知识,是解答本题的关键所在.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:初中化学 来源: 题型:选择题

| A. | 甲中混有少量乙时,可用降温结晶法提纯甲 | |
| B. | t2℃时甲、乙、丙三种物质的饱和溶液降温至t1℃时,甲析出的晶体最多,丙无晶体析出 | |
| C. | t2℃时甲、乙、丙三种物质的饱和溶液降温至t1℃时,溶液中溶质的质量分数为乙>甲>丙 | |
| D. | t2℃时,100g甲物质溶于100g水中,所得溶液的质量为200g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质在水中的溶解过程实质上是原子重新组合的过程 | |
| B. | 水的三态变化中,分子的能量、运动速率不变 | |
| C. | 分子可以再分,原子不能再分 | |
| D. | 分子由原子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
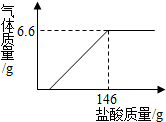 现将19.9g含氢氧化钠的碳酸钠固体中加入100g水充分溶解,向该溶液中逐滴加入一定溶质质量分数的盐酸,生成气体的质量与加入盐酸的质量关系如图所示.请计算
现将19.9g含氢氧化钠的碳酸钠固体中加入100g水充分溶解,向该溶液中逐滴加入一定溶质质量分数的盐酸,生成气体的质量与加入盐酸的质量关系如图所示.请计算查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
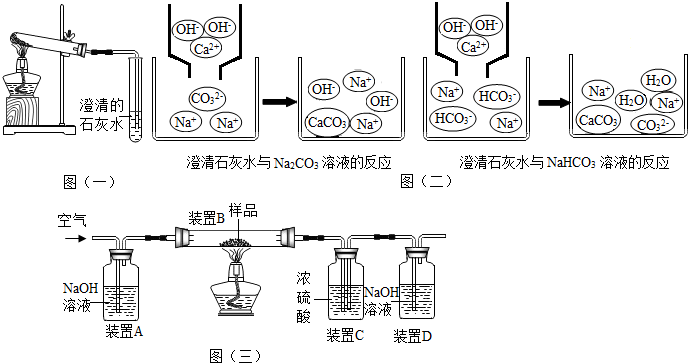
| 装置B | 装置C | 装置D | |
| 实验前物质的质量/g | 180.0 | 200.0 | 122.2 |
| 实验后物质的质量/g | 176.9 | 201.5 | 124.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
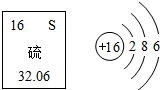 如图是元素周期表中的硫元素及其原子结构示意图,下列说法正确的是( )
如图是元素周期表中的硫元素及其原子结构示意图,下列说法正确的是( )| A. | 硫元素属于金属元素 | B. | 硫原子在化学反应中容易失去电子 | ||
| C. | 硫的相对原子质量为32.06g | D. | 硫离子最外层上有8个电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | SO42-、Na+、K+、Cl- | B. | Ca2+、K+、Cl-、CO32- | ||
| C. | Fe2+、CO32-、K+、Cl- | D. | Al3+、Ag+、K+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com