
为测定某纯碱样品(含少量氯化钠杂质)中碳酸钠的含量,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应。经测定,所得溶液常温下为不饱和溶液,其质量为107.6 g(产生的气体全部逸出)。试计算:
(1)反应生成二氧化碳的质量为 g,12g样品中碳酸钠的质量为 g。
(2)稀盐酸中溶质的质量分数(写出计算过程)。
(1)4.4 10.6
(2) 7.3%
解析试题分析:依据质量守恒定律化学反应前后物质的总质量不变,那么减少的质量为生成二氧化碳的质量;利用化学方程式根据反应的质量即可求出碳酸钠的质量和稀盐酸中溶质的质量。
(1)生成的二氧化碳的质量=12g+100g-107.6g=4.4g
(2)解:设碳酸钠的质量为y,参加反应的H Cl的质量为x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
Y x 4.4g
73∶44 = x∶4.4g x = 7.3g
106/44=y/4.4g y=10.6g
稀盐酸中溶质的质量分数为: 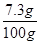 ×100% = 7.3%
×100% = 7.3%
答:稀盐酸中溶质的质量分数为7.3%。
考点:利用化学方程式的计算


科目:初中化学 来源: 题型:单选题
将铜和碳酸钙的混合物在空气中充分灼烧,混合物的质量在冷却后没有变化,则原混合物中铜和碳酸钙的质量比为( )
| A.44:25 | B.25:44 | C.1: 1 | D.无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(5分)小坊同学在实验室用一定量的氯酸钾和二氧化锰混合物制取氧气,加热至固体质量不再减少时,称得固体残渣质量为20.4 g,为了分离出二氧化锰,她向残渣中加入40℃的水30 g,充分溶解,第一次过滤后得到滤液A和8.4 g残渣,她又向残渣中加入40℃ 的水l0 g,充分溶解,第二次过滤后得到滤液B和5.5 g残渣(假设在实验过程中无损失)。请回答下列问题:
(1)反应的化学方程式为 ___________________________
(2)8.4 g残渣的成分是_______;
(3)利用已知条件列出求原混合物中氯酸钾质量(X)的比例式______ :
(4)将滤液A和滤液B混合,并加入45.1g水,求所得溶液的溶质质量分数______ :
(5)原固体混合物中氯酸钾和二氧化锰的质量比为___________________________。
(已知:40℃ 时,氯化钾的溶解度为40 g)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(6分)向20g锌样品(杂质不溶于水,也不溶于酸)中加入100g质量分数为19.6%的稀硫酸,恰好完全反应。试计算该锌样品中锌的质量分数(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(14分)某兴趣小组用下图所示流程制取氧气(反应原理: 2KClO3 2KCl+3O2↑),并回收提纯氯化钾和二氧化锰。
2KCl+3O2↑),并回收提纯氯化钾和二氧化锰。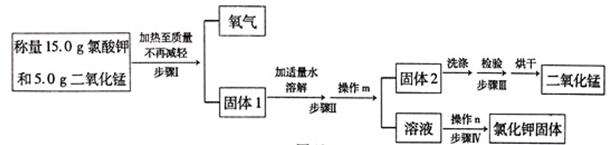
回答下列问题:
(1)根据化学方程式计算,理论上可制得氧气的质量是多少?(计算结果精确到0.1g)
解:
(2)在回收提纯的过程中需要控制水的用量,原因有 (填标号)。
A.提高实验效率 B.保证固体1全部溶解 C.节约能源
(3)①写出下图中仪器a、b的名称: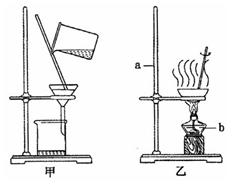
A ,b 。
②步骤Ⅱ中的操作m应选择图11中
(填“甲”或“乙”)装置,该操作中玻璃棒
的作用是 。
③步骤Ⅲ中用酸化的硝酸银(AgNO3)溶液检验洗出液中是否含有氯化钾,该检验方法的原理
为 (用化学方程式表示)。
(4)实验结束后,称得回收到的氯化钾的质量比理论值小,
可能的原因有 (写一点)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某同学为了测定NaCl和MgCl2固体混合物中MgCl2的质量分数,进行如下实验:将80g固体混合物溶于水配成溶液,平均分成四份,分别加入相同质量分数的NaOH溶液,获得如下实验数据:
| 实验次数 | 一 | 二 | 三 | 四 |
| 固体混合物的质量(g) | 20 | 20 | 20 | 20 |
| 加入NaOH溶液的质量(g) | 20 | 40 | 60 | 80 |
| 生成沉淀的质量(g) | 2.9 | m | 8.7 | 8.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀
质量的关系曲线如图所示。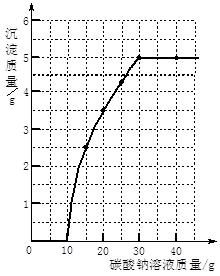
回答下列问题:
(1)从图中看出生成沉淀的最大质量是 g。
(2)开始加入碳酸钠溶液至10g时,还没有沉淀的原
因是 。
(3)计算原滤液中氯化钙的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室有一瓶含硫酸的废液,设计如下方案测定该废液中硫酸的质量分数。取质量为18.2g的洁净小烧杯,往其中倒入一定量硫酸废液后称量,总质量为33.2g,然后,将一枚质量为10.8g的铁钉(已用砂纸打磨去除铁锈,且铁钉不与废液中的其它物质反应)放入该小烧杯中充分反应,待铁钉表面不再有气泡产生后,称量,总质量为43.9g。试计算原硫酸废液中硫酸的质量分数。(计算结果保留小数点后一位)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数。取20g石灰石样品(假设杂质既不溶于水,也不与其他物质反应),向其中加入100g一定溶质质量分数的稀盐酸,恰好完全反应,称得固液混合物的质量为113.4g。请回答下列问题:
(1)写出反应的化学方程式 ;
(2)列出求解该样品中参加反应的碳酸钙质量(x)的比例式 ;
(3)该样品中碳酸钙的质量分数为 ;
(4)向反应后的固液混合物中加入113.6g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为 ;
(5)欲配制150g上述实验所用的稀盐酸,需要36.5%的浓盐酸质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com