
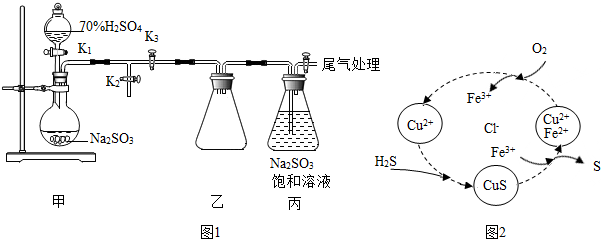
分析 Ⅰ(1)根据亚硫酸钠和硫酸反应生成硫酸钠、水和二氧化硫进行分析;
(2)根据常用的检验装置气密性的方法进行分析;
(3)根据二氧化硫会与亚硫酸钠反应,造成一定的压强差进行分析;
(4)根据焦亚硫酸钠和氧气反应生成Na2S2O7进行分析;
Ⅱ(1)根据H2S转化为硫单质,硫元素的化合价从-2价变成0价,氧元素的化合价从0价变成-2价,依据得失电子数相等进行计算;
(2)根据使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质进行分析;
(3)根据氯化铜和硫化氢反应生成硫化铜沉淀和盐酸,氯化铁和硫化铜反应生成氯化亚铁、氯化铜和硫,氯化亚铁和盐酸、氧气反应生成氯化铁和水进行分析.
解答 解:Ⅰ(1)亚硫酸钠和硫酸反应生成硫酸钠、水和二氧化硫,化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(2)通过分析甲装置,可以采用手加热的方法,观察导管口是否有气泡冒出,也可以采用压强差进行验证,所以检验气密性的方法有:方法1:关闭K2,打开K1,向分液漏斗中加一定量的水,一段时间后水不能继续滴入烧瓶,则表明装置气密性良好;
方法2:关闭K1,打开K2,在K2下端连接导管并插入水面下,双手捂住圆底烧瓶外壁,若导管口有气泡冒出,松开手过一会儿,导管内形成一段水柱,则表明装置气密性良好;
方法3:关闭K1,打开K2,在K2下端连接注射器,先外拉注射器活塞,后松开手,活塞恢复原位,则表明装置气密性良好;
(3)二氧化硫会与亚硫酸钠反应,造成一定的压强差,所以装置乙的作用是:防止倒吸;
(4)焦亚硫酸钠和氧气反应生成Na2S2O7,化学方程式为:Na2S2O5+O2═Na2S2O7;
Ⅱ(1)H2S转化为硫单质,硫元素的化合价从-2价变成0价,氧元素的化合价从0价变成-2价,依据得失电子数相等,所以
2H2S----O2
68 32
所以有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为16g;
(2)使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质,所以氧气必须过量,采取的措施是:增大混合气体中空气的比例;
(3)氯化铜和硫化氢反应生成硫化铜沉淀和盐酸,氯化铁和硫化铜反应生成氯化亚铁、氯化铜和硫,氯化亚铁和盐酸、氧气反应生成氯化铁和水,化学方程式为:CuCl2+H2S═CuS↓+2HCl,2FeCl3+CuS=S↓+2FeCl2+CuCl2,4FeCl2+O2+4HCl=4FeCl3+2H2O.
故答案为:I(1)Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(2)关闭K2,打开K1,向分液漏斗中加一定量的水,一段时间后水不能继续滴入烧瓶,则表明装置气密性良好;
关闭K1,打开K2,在K2下端连接导管并插入水面下,双手捂住圆底烧瓶外壁,若导管口有气泡冒出,松开手过一会儿,导管内形成一段水柱,则表明装置气密性良好;
关闭K1,打开K2,在K2下端连接注射器,先外拉注射器活塞,后松开手,活塞恢复原位,则表明装置气密性良好;
(3)防止倒吸;
(4)Na2S2O5+O2═Na2S2O7;
II(1)16g;
(2)增大混合气体中空气的比例;
(3)CuCl2+H2S═CuS↓+2HCl,2FeCl3+CuS=S↓+2FeCl2+CuCl2,4FeCl2+O2+4HCl=4FeCl3+2H2O.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的提示进行解答.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:初中化学 来源: 题型:解答题
 化学变化中,同种元素可在不同物质中“旅行”.
化学变化中,同种元素可在不同物质中“旅行”.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 制取气体时,先装药品,后检查装置的所密性 | |
| B. | 稀释浓硫酸时,先把浓硫酸倒入烧杯,后加水并用玻璃棒不断搅拌 | |
| C. | 用托盘天平称量药品时,先调节天平平衡,后称量 | |
| D. | 木炭还原氧化铜结束时,先停止加热,后把导管从盛有石灰水的试管中取出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 试剂、方法 | 操作、现象、结论 |
| A | 区别真黄金、假黄金(黄铜) | 稀硫酸 | 观察有无气泡 |
| B | 除去二氧化碳中氯化氢 | 氢氧化钠溶液 | 把气体通入足量溶液中 |
| C | 分离氯化钠和硝酸钾固体 | 水 | 溶解后降温结晶、过滤、蒸发 |
| D | 检验盐酸和氢氧化钠是否恰好反应 | 紫色石蕊溶液 | 观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 红磷在氧气中燃烧产生大量白色烟雾 | |
| B. | 将铝丝插入硫酸铜溶液中,溶液由蓝色变为浅绿色 | |
| C. | 稀硫酸能使无色酚酞溶液变红色 | |
| D. | 硫在空气中燃烧,产生淡蓝色火焰,生成一种刺激性气味的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸 剂”固体样品很好奇,设计实验进行探究.
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸 剂”固体样品很好奇,设计实验进行探究.| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红. | 固体中一定含有CaO 和氢氧化钙. |
| (2)另取少量固体放于试管中,滴加足量的盐酸. | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe, 一定不含Fe2O3. |
| (3)将步骤(2)中产生的气体通入到澄清的石灰水中. | 石灰水变浑浊. | 固体中一定含有CaCO3. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com