
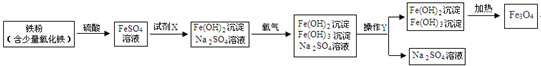
分析 由硫酸亚铁转化为氢氧化亚铁和硫酸钠可以得出试剂1为氢氧化钠.将混合物中沉淀和溶液分开的操作是过滤,过滤时玻璃棒起引流的作用.酸与金属氧化物发生复分解反应.由我们初中知识可知往铁粉(含少量氧化铁)中加入硫酸,铁、氧化铁与硫酸发生反应生成硫酸亚铁和硫酸铁,但生成物中只有硫酸亚铁,可见在里面一定还发生了我们并不知道的其它反应.根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)FeSO4与试剂1生成了Fe(OH)2和Na2SO4,所以试剂1为氢氧化钠;故答案为:NaOH;
(2)将混合物中沉淀和溶液分开的操作是过滤,该操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,过滤时玻璃棒起引流的作用;故答案为:过滤;漏斗;引流;
(3)氧化铁与硫酸反应生成硫酸铁和水,反应的化学方程式为3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;故答案为:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
(4)铁、氧化铁与硫酸发生反应生成硫酸亚铁和硫酸铁,但生成物中只有硫酸亚铁,可见在里面一定还发生了我们并不知道的其它反应.故答案为:生成物只有一种;
(5)根据氢氧化亚铁与氧气、水反应生成氢氧化铁,所以化学方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3.故填:4Fe(OH)2+2H2O+O2═4Fe(OH)3.
由沉淀获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2O,因此,通入氧气时,必须控制“一定量”,其目的是防止氢氧化亚铁被完全氧化成氢氧化铁.故填:防止氢氧化亚铁被完全氧化成氢氧化铁.
(6)设硫酸亚铁质量为x,
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,
152 90
x 4.05g
$\frac{152}{90}=\frac{x}{4.05g}$
x=6.84g,
FeSO4溶液中溶质的质量分数是:$\frac{6.84g}{100g}$×100%=6.84%,
设最终得到产品四氧化三铁质量为y,
由反应过程可知,硫酸亚铁中的铁元素完全转化到四氧化三铁中,
根据题意有:6.84g×$\frac{56}{152}×100%$=y×$\frac{56×3}{232}×100%$
=3.48g,
答:FeSO4溶液中溶质的质量分数是6.84%,最终得到产品四氧化三铁质量是3.48g.
点评 本考点考查了流程图型物质的制备,由生成物可以判断反应物,同时也可以根据生成物的种类,来判断发生了几个反应,对于我们还没有学过的反应,不能认为不存在.要结合物质的性质,灵活应用,答案就会迎刃而解.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
| A. | A2B3 | B. | A3B4 | C. | A2B5 | D. | AB |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
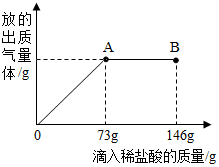 已知 Na2CO3溶液呈碱性.在一烧杯中盛有20.4g Na2CO3和NaCl组成的固体混合物,向其中逐渐滴加10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示.请回答:
已知 Na2CO3溶液呈碱性.在一烧杯中盛有20.4g Na2CO3和NaCl组成的固体混合物,向其中逐渐滴加10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 10% | B. | 30% | C. | 50% | D. | 70% |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 能溶于水 | B. | 水溶液能使鸡蛋清变性 | ||
| C. | 晶体加热颜色会变白 | D. | 水溶液中滴加氢氧化钠会产生沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
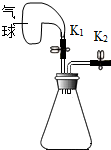 某同学利用如图装置进行如下实验(装置气密性良好).
某同学利用如图装置进行如下实验(装置气密性良好).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com