
| 实验步骤 | 实验现象 | 实验结论 |
| 取样逐滴滴加稀盐酸 | 开始时无明显现象,过一段时间后有大量气泡产生 | 该瓶氢氧化钠溶液部分(填“全部”或“部分”)变质,滴加稀盐酸后发生反应的化学方程式:①aOH+HCl=NaCl+H2O、②Na2CO3+2HCl=2NaCl+CO2↑+H2O |

分析 (1)根据氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水解答;
(2)根据碳酸钠溶液显碱性解答;
(3)检验碳酸钠的存在,可加入稀盐酸,观察是否有气泡产生解答;
(4)①根据为了使碳酸钠完全反应,应该加入过量的氯化钡溶液解答;
(5)根据碳酸钠和氯化钡反应生成的碳酸钡沉淀和氯化钠,因此步骤③过滤出的沉淀物是碳酸钡解答;
(6)利用沉淀物的质量计算碳酸钠的质量分数时,若不洗涤沉淀,那么沉淀上会附着一些杂质,从而使沉淀的质量增大,会导致计算出的氢氧化钠质量偏大,使所测定氢氧化钠的质量分数偏大
解答 解:(1)氢氧化钠易吸收空气中的水而潮解,吸收空气中的二氧化碳生成碳酸钠而变质,氢氧化钠变质的化学方程式:2NaOH+CO2═Na2CO3+H2O;
(2)小华同学首先否定了方案A,其理由是碳酸钠溶液显碱性;
(3)检验碳酸钠的存在,可加入稀盐酸,观察是否有气泡产生;开始时无明显现象,是因为盐酸先与氢氧化钠反应,氢氧化钠被消耗完,盐酸再和碳酸钠反应,生成氯化钠、水和二氧化碳气体,有大量气泡产生,说明该瓶氢氧化钠溶液部分变质,滴加稀盐酸后发生反应的化学方程式:①NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+CO2↑+H2O.
(4)①加足量氯化钡溶液的目的是除去碳酸钠,防止影响对NaOH的检验.加一定量氯化钡溶液后,判断所加氯化倍溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加碳酸钠溶液,产生白色沉淀,氯化钡已经过量.
(5)碳酸钠和氯化钡反应生成的碳酸钡沉淀和氯化钠,因此步骤③过滤出的沉淀物是碳酸钡
(6)利用沉淀物的质量计算碳酸钠的质量分数时,若不洗涤沉淀,那么沉淀上会附着一些杂质,从而使沉淀的质量增大,会导致计算出的氢氧化钠质量偏大,使所测定氢氧化钠的质量分数偏大.
答案:
(1)2NaOH+CO2═Na2CO3+H2O;
(2)碳酸钠溶液显碱性;
(3)
| 实验步骤 | 实验现象 | 实验结论 |
| 取样逐滴滴加稀盐酸 | 开始时无明显现象,过一段时间后有大量气泡产生 | 该瓶氢氧化钠溶液 部分(填“全部”或“部分”)变质,滴加稀盐酸后发生反应的化学方程式:①aOH+HCl=NaCl+H2O、②Na2CO3+2HCl=2NaCl+CO2↑+H2O |
点评 实验是化学的重要组成部分,正确的实验操作是得出科学结论的前提条件之一,因此要学会设计实验、进行实验、分析实验,为得出正确的结论奠定基础.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:初中化学 来源: 题型:解答题
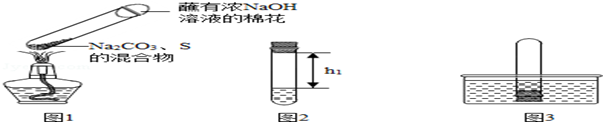
| 第1次 | 第2次 | 第3次 | |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
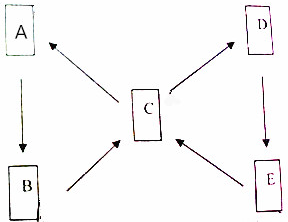 A、B、C、D、E都是含铜元素的物质,其中,A为单质,其它都是铜的化合物且铜元素在这些化合物中都显+2价,B为黑色物质,C为一种硫酸盐且为蓝色溶液,D和胃液中的酸含有一种相同的元素,E为蓝色沉淀,它们的转化关系如图所示,请你结合信息推断:
A、B、C、D、E都是含铜元素的物质,其中,A为单质,其它都是铜的化合物且铜元素在这些化合物中都显+2价,B为黑色物质,C为一种硫酸盐且为蓝色溶液,D和胃液中的酸含有一种相同的元素,E为蓝色沉淀,它们的转化关系如图所示,请你结合信息推断:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 下列数据是硝酸钾和氯化钠在不同温度时的溶解度.
下列数据是硝酸钾和氯化钠在不同温度时的溶解度.| 温度/℃ | 10 | 30 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com