
 硝酸钾与氯化钾的溶解度曲线如右图所示,回答下列问题:
硝酸钾与氯化钾的溶解度曲线如右图所示,回答下列问题:分析 根据溶液的质量、溶解度曲线可以判断温度变化时析出固体质量的多少;
饱和溶液的质量分数=$\frac{溶解度}{100g+溶解度}$×100%;
从溶液中结晶的方法有两种:蒸发结晶和降温结晶,物质的溶解度受温度变化影响较小时,应该用蒸发结晶;物质的溶解度受温度变化影响较大时,应该用降温结晶.
解答 解:(1)t2℃降温至t1℃时,硝酸钾的溶解度质量差大于氯化钾的溶解度质量差,因此t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是硝酸钾的溶液.
故填:硝酸钾.
(2)t2℃时,氯化钾的溶解度是40g,将50g水加入盛有25g氯化钾的烧杯中,充分溶解后,只能够溶解20g,得到氯化钾溶液的质量是70g;
保持温度不变,往该烧杯中再加入5g水,充分搅拌后,又有2g溶解,仍然是饱和溶液,因此氯化钾溶液的溶质的质量分数不变.
故填:70;不变.
(3)由溶解度曲线可知,的溶解度受温度变化影响较大,氯化钾的溶解度受温度变化影响较小,硝酸钾当硝酸钾中混有少量氯化钾时,可用降温结晶方法提纯硝酸钾.
故填:降温结晶.
点评 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.


 小学课时特训系列答案
小学课时特训系列答案科目:初中化学 来源: 题型:选择题
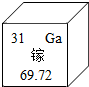 镓元素的相关信息如图.下列有关镓的说法不正确的是( )
镓元素的相关信息如图.下列有关镓的说法不正确的是( )| A. | 元素符号是Ga | B. | 相对原子质量为69.72g | ||
| C. | 属于金属元素 | D. | 原子的核外电子数是31 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | “苏丹红一号”是一种有机化合物 | |
| B. | “苏丹红一号”的相对分子质量是248 | |
| C. | “苏丹红一号”中碳元素的质量分数最高 | |
| D. | “苏丹红一号”含有16个碳原子、12个氢原子、2个氮原子和1个氧原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
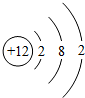 某元素的一种粒子的结构示意图如图所示,下列对该粒子的判断中,错误的是( )
某元素的一种粒子的结构示意图如图所示,下列对该粒子的判断中,错误的是( )| A. | 该粒子是金属元素的原子 | |
| B. | 该元素在化合物中显-2价 | |
| C. | 该元素1个原子的原子核内有12个质子 | |
| D. | 该元素的原子在化学反应中容易失去电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | 盐酸的质量分数/% | 反应温度/℃ | 铁锈消失的时间/s |
| ① | 6 | 20 | 240 |
| ② | 10 | 20 | 115 |
| 实验编号 | 硫酸的质量分数/% | 反应温度/℃ | 铁锈消失的时间/s |
| ③ | 6 | 20 | 310 |
| ④ | 10 | 20 | 155 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com