
����Ŀ�����г�������Ʒ20g��Ϊ�˲ⶨ�����������ĺ�����ͬѧ����ʵ�鰸�ҵ�һƿδ֪Ũ�ȵ�ϡ�����������������16%������������Һ��ʵ�������ͼ��ʾ����ش����⣺

��1��д����������ϡ���ᷢ����Ӧ�Ļ�ѧ����ʽ_____��
��2���ó�����ʯ���������ĺ���Ϊ_____��
��3��������֪�����г��μӷ�Ӧ���Ȼ���������x���ı���ʽ_____��
��4����������������Һ�м���2.7gˮ�������ò�������Һ��������������Ϊ_____��
��5������������������Ϊ36.5%��Ũ��������ʵ������ϡ���ᣬ����ҪŨ�����ˮ��������Ϊ_____��
��6������20t����������ʯ�����������ʯ��������Ϊ84%������Ƶú�����4%����������Ϊ_____t��
���𰸡�Fe2O3+6HCl�T2FeCl3+3H2O 80% ![]() ��������Ҳ�� 11.7% 2��3 9.8
��������Ҳ�� 11.7% 2��3 9.8
��������
�⣺25g16%������������Һ����������100g16%������������Һ��ʼ����������һ��ʱ���ʼ�������ɫ����������Ϊ10.7g�������ɵ��������Ƶ�����Ϊ10.7����֪��ʼ�õ�����Һ����ʣ���HCl��������������������һ����Һ�����Ե�ȫ����ҺʱӦ�ö�Ӧ200g16%������������Һ��Ӧ����21.4g��������������
������ʯ������������������Ϊy�����ɵ��Ȼ���������Ϊx
Fe2O3+6HCl�T2FeCl3+3H2O
FeCl3+3NaOH��Fe��OH��3��+3NaCl
�ɵù�ϵʽΪ��
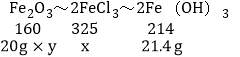
![]()
x��32.5g
y��80%
�������õ�����Һ��Ӧ����һ�����Һ���������ĵ������������һ�롣
�����ɵ��Ȼ��Ƶ�����Ϊa�����ĵ���������Һ��������Ϊb
HCl�е���Ԫ�����պ����������е���Ԫ�ؽ�ϣ��ɵù�ϵʽΪ
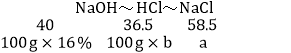
![]()
a��23.4g
b��14.6%
��������������Ϊ36.5%��Ũ��������ʵ������ϡ���ᣬ����ҪŨ����![]() ����Ҫ��ˮ������Ϊ200g��80g��120g��
����Ҫ��ˮ������Ϊ200g��80g��120g��
Ũ�����ˮ��������Ϊ80��120��2��3��
����������Һ�м���2.7gˮ�������ò�������Һ��������������Ϊ![]()
��20t����������ʯ�����������ʯ��������Ϊ84%������Ƶú�����4%����������Ϊz
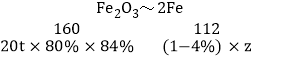
![]()
z��9.8t


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij����ĵ����и�Ԫ�صĺ���Ϊ![]() �����в�����Ԫ��
�����в�����Ԫ��![]() ��ȡ��������ϴ�������ﲢ�����ȡ10g�����ձ��Ȼ�����ձ��м���������ϡ����90g����ַ�Ӧ�Ƶ��ձ������ʵ�������Ϊxg�������й�����������ǣ� ��
��ȡ��������ϴ�������ﲢ�����ȡ10g�����ձ��Ȼ�����ձ��м���������ϡ����90g����ַ�Ӧ�Ƶ��ձ������ʵ�������Ϊxg�������й�����������ǣ� ��
A. ���Լ����10g������̼��Ƶ�����
B. ����������x����ֵ�����������![]() ������
������
C. ���Լ����10g������̼��Ƶ���������
D. ���Լ����ϡ����ͷ�Ӧ��������Һ��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����Ƴ����д����ᴿ��ʵ�鷽��������һ��������������⣮

(1)�����٢ڢ۵�����������_____��_____��_____�����ڲ����ڽ���������Һ�Ի��ǣ�Ӧ��ȡ�Ĵ�ʩ��_____��
(2)ʵʩ������ʱ������Ҫ���Ͻ��裬ֱ��_____ʱֹͣ���ȣ�
(3)���㾫�εIJ�����_____(������ȡС�����һλ)��
(4)�����εIJ���ƫ�ͣ�����ܵ�ԭ����_____(����ĸ���)
A ����ʱ��ֽ������
B ����ʱ�й��彦��
C �ܽ⺬����ɳ�Ĵ���ʱ�������ˮ������
D ת�ƾ���ʱ�����������в����Ĺ��壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���������ȼ�������ɼ�����ȡ���ش�ͻ�ƣ�������ȼ�����пɻ�ü��顣
��1�������ڿ�����ȼ�յĻ�ѧ����ʽ��__________��
��2�����۽�һ����ʶ��ѧ��Ӧ����ͼ��һ���������������ַ�Ӧ����ʾ��ͼ��

�ٸû�ѧ��Ӧ���������仯��������__________(����ĸ���)��
A ̼ԭ�� B ��ԭ�� C ��ԭ�� D ������� E ������
�ڸ���ʾ��ͼ���ֳ���Ӧǰ�����������������Ͽ�����__________(����ĸ���)��
A 16g�����64g���� B 8g�����32g����
C 20g�����64g���� D 16g�����96g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ�����������������н�1/2Ϊ����Դ��������һ̨���綯��������ʣ20%�ĵ�����������ֻ��Ҫ15���ӣ�����һ�ζ�������ʻ150�������ң��ļ�����ʻ250�������ҡ���ش����⣺
��1�����������β��ֲ��ϲ��������Ƴɣ������������Ȳ��ۻ���������_____�������ȹ����������������������ϡ��е�����Ϊ�˷�������������һ������֯��������ŵ�����____��дһ�㣩��
��2�����綯�������ĵ�����Ӫ�ɱ���Ϊȼ������������֮һ�����ͳɱ���ͬʱ�������ȼ��������������ŷ�_____���ѧʽ�����к����ʵ����⡣
��3���������������Ϊ���Ͻ����Ͻ�������_____���ϡ������������������ղ����䣬��������ͻ����⣬������Ҫ�ɷֻ�ѧʽΪ��_____��������Ĺ��̱Ƚϸ��ӣ���ͼ2��ʾ��
�ڶ�����Ӧǰ����Ԫ�صĻ��ϼ۱仯�������_____����
��������Ӧ�Ļ�ѧ����ʽΪ��_____��
����������߱���������Ҳ����δ�ֽ������������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ࡢ����dz��л�ѧ���õ�ѧϰ������
��1�����л�ѧ������ʵ�飬������ʵ�鷽�����࣬�ɽ�ʵ���_____������ĸ����Ϊһ�ࣻ����������Ǣ�_____��

��2�����л�ѧ�������Ѿ�ѧ������������������ʷ֣������������Ϊ������������ͼ���������ȣ���������������ָ���ǣ�����Ӧ�����κ�ˮ��������������������Ӧ�����и�Ԫ�صĻ��ϼ۲��䣬��P2O5���������������д��P2O5������������Һ��Ӧ�Ļ�ѧ����ʽ��_____������ͭ��һ�ּ�����������������ͭ���ᷴӦ��������Ʋ����������Ķ����Ǣ�_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȳ��C2H2�����������������Щ�������ƣ���Ȳ��������Ӧ�ܲ������»��棬����ʦ��������Ȳ���и�ӽ�������Ȳ��̼���ƣ���״���壬��ѧʽΪCaC2����ˮ��Ӧ���ɣ�ͬʱ����һ�ְ�ɫ���壮
��������⣩��ɫ������ʲô���ʣ�
���������룩С������˼����Ϊ�����¼��ֿ��ܣ�
����һ��CH4���������______����������Ca(OH)2������������______________��
��������˼������ͬѧ�ǽ������ۣ���Ϊ����һ������������һ�������ǣ�______��
������ʵ�飩ȡ������ɫ������뵽ˮ�У�ȡ�ϲ���Һ��_________________���а�ɫ�������֣�֤���������������÷�Ӧ�Ļ�ѧ����ʽΪ��____________________ ��
���ۣ���ɫ������Ca(OH)2��
����չӦ�ã�
��1����֪̼������ˮ��Ӧ�dz����ң���Ȳ���ܶȱȿ�����С��ʵ��������ȡ���ռ���������Ȳ��Ҫ��������Լ����ȫ����ʱ��������ʱֹͣ����ѡ���װ����______��ѡ��ͼ��װ����ţ���
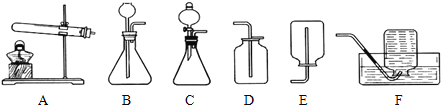
��2��д����Ȳ�ڿ�����ȼ�յĻ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijͬѧ�ⶨ����������������װ�á���������װ����ϸͭ˿������֪��ͭ+����![]() ����ͭ������ͭ�ǹ��壩
����ͭ������ͭ�ǹ��壩
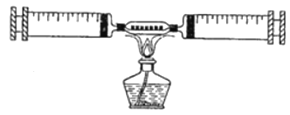
��1��������ǰ����ע������ɵ��ܱ�ϵͳ����30mL������ֹͣ������ȴ�����º��������ܱ�������ʣ�����������Ϊ_____mL���ɴ�֤������������Լռ�����������_____��
��2����ͬ��ͬѧ��������ʵ��ʱ������ϴ�ͬѧ���ʣ������26mL������Ϊ���ܵ�ԭ������Щ��
��_____��_____��
��3��������ɺ���ʵ�飬ȼ�յ�����Ϊ_____�����ֱ���ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˴ﵽ��Ӧ��ʵ��Ŀ�ģ�����ʵ�������������
A. 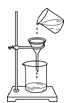 ��ȥ�����еIJ�����������ɳB.
��ȥ�����еIJ�����������ɳB.  �ⶨij������Һ��pH
�ⶨij������Һ��pH
C. 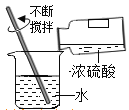 ϡ��Ũ����D.
ϡ��Ũ����D. 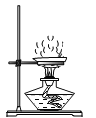 ����ʳ��ˮ�õ�ʳ�ξ���
����ʳ��ˮ�õ�ʳ�ξ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com