
���� ��1����������Ӫ���ص����úͷֲ����
��2�����ݸ�������Ϣ������ɣ�
��3���������ĵĵ�������Ͷ�Ӧ�Ļ�ѧ����ʽ����ά����C����������������������������
��� �⣺��1��ά����C��C6H8O6���ֽп���Ѫ�ᣬ��Ҫ�������߲˻���ˮ����ʳ���У�����ǿ����Ŀ�������������ȱ��ά����C������Ѫ����
��2����ȡ3��ά����Cѹ�������10mLˮ�У�Ȼ����ˣ�ȡ������Һ�������еμӼ�����ɫʯ����Һ����Һ���ɫ������ʯ�������죬����˵��ά����C��ˮ��Һ�����ԣ� ����ά����C�����Ի����бȽ��ȶ�������ʱ�ױ��ƻ���������ʳ�ûƹ�����ͼӴײ��ܳ�����ûƹ��зḻ��ά����C����������ʵ�ʳ�÷����ǼӴ����裮
��3����2g��ά����CҩƬ�к��е�ά����C������Ϊx
C6H8O6+I2=C6H6O6+2HI
176 254
x 2.54g
$\frac{176}{254}$=$\frac{x}{2.54g}$
x=1.76g��
��VcҩƬ��ά����C����������Ϊ$\frac{1.76g}{2g}$��100%=88%��
�ʴ�Ϊ��
��1���߲˻���ˮ���� ��Ѫ��
��2��� �Ӵ����裮
��3��88%��
���� ���ݻ�ѧ����ʽ����ʱ����һҪ��ȷ��д��ѧ����ʽ���ڶ�Ҫʹ����ȷ�����ݣ������������Ҫ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��չ�� | B�� | ������ | ||
| C�� | Ӳ�ȴ� | D�� | ��Ư���Ľ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �ƹ�֭ | �ཷ֭ | �۲�֭ | �ײ�֭ | |
| ���������Һ��2������ | 14�� | 8�� | 15�� | 11�� |
| A�� | �ƹ� | B�� | �ཷ | C�� | �۲� | D�� | �ײ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
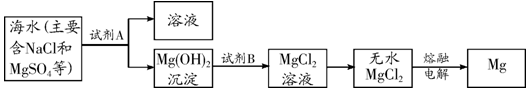
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڹ�֭�м��롰�ܻ�����ʹ��ڸи��� | |
| B�� | ���Һõļ����м��������ļӵ��ε�ζ | |
| C�� | Ϊ���ӳ�����ʱ�䣬�ü�ȩ��Һ���ݺ���Ʒ | |
| D�� | ����˵�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | īˮ | C�� | ���� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ֲ��ɷ� | K2O | NA2O | CaO | MgO | FE2O3 | P2O5 | SO2 | SiO2 | Cl |
| ������ | 30.2 | 0.6 | 3.5 | 13.2 | 0.6 | 47.5 | - | 0.7 | - |
| ���� | 13.6 | 1.4 | 5.8 | 2.5 | 0.6 | 408 | - | 67.4 | - |
| �������� | 29.8 | 1.1 | 2.2 | 15.5 | 0.8 | 45.6 | 0.8 | 2.1 | 0.9 |
| ������ | 27.2 | 0.8 | 5.7 | 11.4 | 0.8 | 9.1 | - | 40.2 | - |
| �������龥 | 60.0 | 3.0 | 2.6 | 4.9 | 1.1 | 16.9 | 6.5 | 2.1 | 3.4 |
| ��ľ�� | Ϊ���� | ��ţ�� | �������� |
| P205 K2CO3 | CO��NH2��2 | P205 CO��NH2��2 | K2CO3 CO��NH2��2 P2O5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | OH- | Cl- | SO42- |
| H+ | �ܡ��� | �� | |
| Na+ | �� | �� | �� |
| Ca2+ | | �� | |
| Cu2+ | �� | �� | �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com