
【题目】将铁粉和铜粉混合物7.0g,加入到盛有60.0 g稀盐酸的烧杯中,恰好完全反应。此时烧杯内各物质的总质量为66.8 g。试计算:
(1)原混合物中铁粉的质量分数。(精确到0.1%)
(2)反应后所得溶液中溶质的质量分数。(精确到0.1%)
【答案】解:生成H2的质量=7.0 g + 60 .0g—66.8 g = 0.2 g ………(1分)
设原混合物中Fe的质量为x,生成FeCl2的质量为y
Fe + 2HCl = FeCl2 + H2↑ ………(1分)
56 127 2
X y 0.2 g ………(1分)
56∶2 =x∶0.2 g x=5.6 g
127∶2=y∶0.2 g y=12.7 g
(1)原混合物中Fe的质量分数=5.6 g÷7.0 g×100% =80.0% ………(1分)
(2)反应后所得溶液中FeCl2的质量分数=12.7 g÷(5.6 g+60.0g—0.2 g)×100% =19.4% ………(2分)
答:略
(其他合理解答也可酌情给分)
【解析】分析:由于反应后生成的氢气从烧杯内逸出,因此由金属混合物的质量、稀硫酸的质量和反应后烧杯内该物质的总质量可以计算出生成的氢气的质量;
由氢气的质量,根据铁与稀硫酸反应的化学方程式可以计算出参加反应的铁的质量和生成氯化亚铁的质量,进而计算出混合物中铁粉的质量分数和反应后所得溶液中溶质的质量分数.
解:生成H2的质量=7.0g+60.0g-66.8g=0.2g
设原混合物中Fe的质量为x,生成FeCl2的质量为y
Fe+2HCl=FeCl2+H2↑
56 1272
xy0.2g![]() ,
,
x=5.6g,y=12.7g
(1)原混合物中Fe的质量分数=![]() ×100%=80.0%
×100%=80.0%
(2)反应后所得溶液中FeCl2的质量分数=![]() ×100%=19.4%
×100%=19.4%
答:(1)原混合物中铁粉的质量分数为80.0%.
(2)反应后所得溶液中溶质的质量分数为19.4%.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:初中化学 来源: 题型:
【题目】下列化学现象的描述,正确的是
A. 红磷燃烧产生大量的白烟 B. 铁在氧气中燃烧,火星四射,生成白色固体
C. 硫在氧气中燃烧发出淡蓝色火焰 D. 木炭在空气中燃烧,发出白光
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列物质由地壳中含量最多的金属元素、非金属元素和空气中含量最多的元素组成是
A.CaCO3 B.Al2(SO4)3 C.Al(NO3)3 D.Fe(OH)3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家最新发现,通过简单的化学反应,可以将树木纤维素转变成超级储能装置,如图是该反应的微观示意图,下列说法错误的是
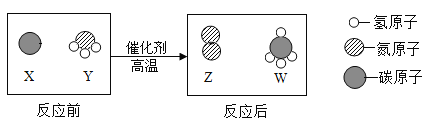
A.化学反应前后原子的种类、个数、质量均保持不变
B.W物质中碳元素的质量分数为75%
C.参加反应的X、Y两物质的粒子个数比为3:4
D.该反应不属于置换反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上将氢气与氯气(Cl2)在点燃的条件下反应生成氯化氢(HCl),用水吸收氯化氢制盐酸.氢气在氯气中燃烧的化学方程式为______________________,反应的基本类型是_________________.向滴有酚酞的氢氧化钠溶液中滴加稀盐酸.溶液由红色变成无色,该反应的化学方程式为__________________________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】除去CO2中混有的少量CO,下列方法正确的是( )
A.将混合气体点燃
B.将混合气体通过入灼热的氧化铜中
C.将混合气体通入水中
D.将混合气体通入到澄清的石灰水中
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定液化气中丙烷(![]() )在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | 丙烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 4.4 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
下列判断正确的是
A.表中a的值为5.6 B.X可能是该反应的催化剂
C.X可能含有氢元素 D.X只含碳元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是人类生活不可缺少的物质.下列有关水的叙述不正确的是( )
A.水是由氢气和氧气组成的
B.冰水混合物是纯净物
C.煮沸可以将硬水软化
D.利用吸附、沉淀、过滤和蒸馏等方法可以净化水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com