
| 实验序号 | 实验过程 | 实验现象 |
| 1 | 镁粉和铁粉分别与5%盐酸反应 | 镁粉产生气体快 |
| 2 | 铁粉和铁片分别与15%盐酸反应 | 铁粉产生气体快 |
| 3 | 铁片分别与5%盐酸和15%盐酸反应 | 15%盐酸产生气体快 |
分析 (1)金属具有良好的导电性、导热性和延展性;
(2)在空气中,铝能和空气中的氧气反应生成氧化铝;
(3)根据实验现象可以判断相关方面的问题;
(4)锌比铜活泼,铜比银活泼,将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中时,硝酸银先和锌反应生成硝酸锌和银,当锌完全反应后,硝酸银再和铜反应生成硝酸铜和银.
解答 解:(1)铜可用来制作导线,是因为其具有良好的延展性和导电性.
故填:导电性.
(2)在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是氧化铝.
故填:氧化铝.
(3)由此得出影响金属与酸反应快慢的因素有:
a:金属活动性,活动性越强,反应速率越快;
b:金属与酸的接触面,接触面越大,反应越快;
c:酸的浓度,酸的浓度越大,反应越快.
故填:金属活动性,活动性越强,反应速率越快;金属与酸的接触面,接触面越大,反应越快;酸的浓度,酸的浓度越大,反应越快.
(4)①锌和硝酸银溶液反应的化学方程式是:Zn+2AgNO3═Zn(NO3)2+2Ag.
故填:Zn+2AgNO3═Zn(NO3)2+2Ag.
②若滤液为蓝色,说明铜和硝酸银反应生成了硝酸铜,则滤液中一定含有的金属离子是Zn2+、Cu2+.
故填:Zn2+、Cu2+.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:选择题
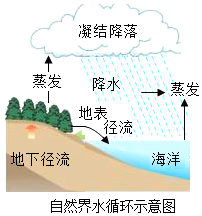 下列关于水的天然循环的说法中正确的是( )
下列关于水的天然循环的说法中正确的是( )| A. | ①②③ | B. | ①③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 一定有银生成 | B. | 所得溶液中一定有Fe2+ | ||
| C. | 一定有铜生成 | D. | 所得溶液中可能有Cu2+、Ag+ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 蒸发掉适量的溶剂 | |
| B. | 加适量的固体NaOH | |
| C. | 加入一定量质量分数高于30%的NaOH | |
| D. | 降低溶液的温度 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 反应前后各元素化合价不变 | |
| B. | 该反应既不是化合反应也不是分解反应 | |
| C. | 反应过程中有单质生成 | |
| D. | 发生反应的分子个数比为1﹕3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 生活中处处体现化学知识,下面是一些常用的灭火事例:①熄灭酒精灯时,用灯帽盖灭②熄灭燃气灶火焰时,关闭阀门③煤矿着火用液氮灭火④森林着火时,将大火蔓延线路前的一片树木砍掉⑤房屋着火时,用高压水枪灭火⑥生日宴会时,用嘴吹灭蜡烛
生活中处处体现化学知识,下面是一些常用的灭火事例:①熄灭酒精灯时,用灯帽盖灭②熄灭燃气灶火焰时,关闭阀门③煤矿着火用液氮灭火④森林着火时,将大火蔓延线路前的一片树木砍掉⑤房屋着火时,用高压水枪灭火⑥生日宴会时,用嘴吹灭蜡烛查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com