
| 测量项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
| 体积 | 80.0 | 54.5 | 126.0 |
分析 探究一:(1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据B装置制取氧气的反应物是固体,反应条件是加热,试管口有一团棉花,所以是高锰酸钾制取氧气,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,向上排空气法收集的氧气干燥,氧气密度比空气大,氧气有助燃性进行分析;
(3)根据铁和氧气在点燃的条件下生成四氧化三铁,以及改进后的装置特点进行分析;
(4)根据可燃物燃烧的剧烈程度与氧气的浓度有关进行分析;
(5)根据过氧化氢在二氧化锰的催化作用下生成水和氧气进行分析;
探究二:(1)根据题干可以知道该实验目的为探究空气中氧气的含量,可以据此解答该题;
(3)根据红磷、硫和木炭燃烧的产物进行解答;
(4)根据红磷燃烧放出热量,生成大量的白烟,红磷燃烧消耗了氧气而使瓶中压强减小,所以烧杯中的水会进入到瓶中约占瓶中体积的五分之一进行分析;
(5)根据(4)中的实验现象来推断结论;
(6)根据红磷和氧气在点燃的条件下生成五氧化二磷进行分析;
(7)根据该实验中的注意事项进行解答;
(8)根据燃烧后水进入的体积和剩余的空间进行解答;
(9)根据铁生锈的知识进行分析解答即可.
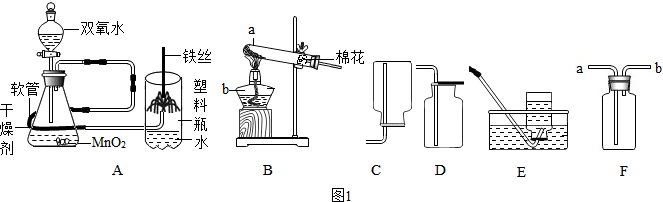
解答 解:探究一:(1)通过分析题中所指仪器的作用可知,a是试管,b是酒精灯;
(2)B装置制取氧气的反应物是固体,反应条件是加热,试管口有一团棉花,所以是高锰酸钾制取氧气,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,表达式为:高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气(2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑),向上排空气法收集的氧气干燥,所以要收集干燥的氧气应选用的收集装置为D,氧气密度比空气大,氧气有助燃性,所以用F装置收集氧气,则应从a端通入,验满的操作方法是:将带火星的木条放在导管口,木条复燃,证明集满;
(3)铁和氧气在点燃的条件下生成四氧化三铁,实验现象为:剧烈燃烧,火星四射,生成黑色固体,放出大量的热,实验装置改进后,氧气无需提前制备和收集,操作更方便;塑料瓶代替集气瓶,防止集气瓶炸裂,更安全;装置集氧气的制取、干燥和性质验证一体,实验更优化,故选:①②③;
(4)根据带火星的木条是否复燃可以得出的结论是:带火星的木条是否复燃与氧气的浓度有关;
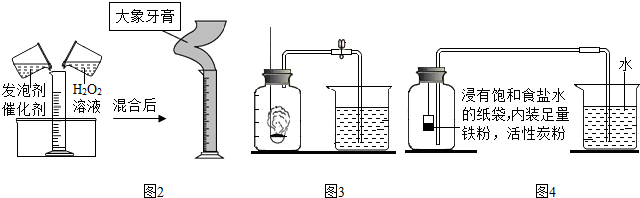
(5)通过分析可知,在量筒中涌出柱状的泡沫,可形象地称为“大象牙膏”,其原理主要是:双氧水在某些催化剂作用下迅速分解产生水和氧气,表达式为:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气(2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑);
探究二:(1)根据题干可以知道该实验目的是:探究空气中氧气的含量;
(3)红磷燃烧生成白色固体,硫燃烧生成二氧化硫气体,木炭燃烧生成二氧化碳气体,本实验的目的是测定氧气的含量,所以所选的物质不能生成气体,否则不能产生压强差,从而也就难以测定出氧气的含量,所以本实验中应该选择红磷来进行实验,故选A;
(4)实验现象为:红磷燃烧放出热量,生成大量的白烟,红磷燃烧消耗了氧气而使瓶中压强减小,所以烧杯中的水会进入到瓶中约占瓶中体积的五分之一;
(5)根据(4)中的实验现象来推断结论为:氧气约占空气体积的五分之一;
(6)红磷燃烧产生了五氧化二磷,化学方程式为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(7)该实验中应该提供足量的红磷以保证尽可能的将氧气消耗尽,同时要等装置冷却之后再打开止水夹,否则得到的结论会与实际结论有偏差;
(8)根据燃烧后水进入的体积为集气瓶体积的五分之一,而不是全部,所以可以判断氮气的物理性质为难溶于水,而过量的红磷没有完全燃烧,说明氮气不支持燃烧;
(9)①铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],化学方程式为:2Fe+2H2O+O2=2Fe(OH)2;
②根据反应前后烧杯内水的体积变化可以看出,消耗的氧气的体积是:80-54.5=25.5mL,所以氧气的体积分数为:$\frac{25.5mL}{126mL}$×100%=20.2%;
③使用铁的缓慢氧化消耗氧气,使氧气消耗的更为彻底,实验结果更准确,测量时考虑导管容积和扣除内容物后的集气瓶的体积,使实验结果更为准确,所以改进后的实验结果比前者准确度更高的原因是:铁的缓慢氧化使集气瓶中的氧气消耗更为彻底,使实验结果更准确;测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确.
故答案为:探究一:(1)试管,酒精灯;
(2)高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气(2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑),D,a,将带火星的木条放在导管口,木条复燃,证明集满;
(3)剧烈燃烧,火星四射,生成黑色固体,放出大量的热,①②③;
(4)带火星的木条是否复燃与氧气的浓度有关;
(5)双氧水在某些催化剂作用下迅速分解产生水和氧气,过氧化氢$\stackrel{二氧化锰}{→}$水+氧气(2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑);
探究二:(1)探究空气中氧气的含量;
(3)A;
(4)红磷燃烧放出热量,生成大量的白烟,红磷燃烧消耗了氧气而使瓶中压强减小,所以烧杯中的水会进入到瓶中约占瓶中体积的五分之一;
(5)氧气约占空气体积的五分之一;
(6)4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(7)红磷的量不足,没有等装置冷却就打开止水夹;
(8)难溶于水,不支持燃烧;
(9)①2Fe+2H2O+O2=2Fe(OH)2;
②20.2%;
③铁的缓慢氧化使集气瓶中的氧气消耗更为彻底,使实验结果更准确;测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.


科目:初中化学 来源: 题型:选择题
| A. | 水在通电下放出H2和O2,说明水是由氢、氧两种元素组成 | |
| B. | 碳能在氧气中燃烧,说明氧气有可燃性 | |
| C. | 锌跟硫酸发生置换反应放出H2,说明硫酸中含有H2 | |
| D. | 二氧化碳能促进植物的生长,说明空气中CO2越多越好 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 浓度 时间/min 催化剂 | 30% H2O2 溶液 | 15% H2O2 溶液 | 5% H2O2 溶液 |
| 加入wg MnO2 | 0.2 | 0.8 | 2.0 |
| 加入wg Fe2O3 | 7.0 | 9.0 | 16.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子、原子一定能够保持物质的化学性质 | |
| B. | 分子、原子都在永不停息的做无规则运动 | |
| C. | 原子得失电子形成离子,离子也可以变回原子 | |
| D. | 化学变化中分子一定可分,原子一定不可分 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com