
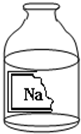
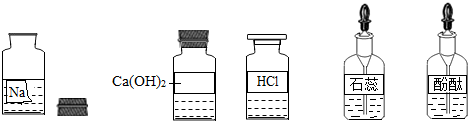
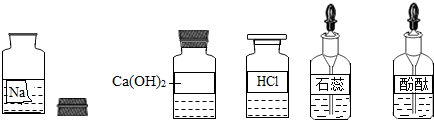
 某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:
某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:

科目:初中化学 来源: 题型:阅读理解
 某校兴趣小组同学准备进行常见的酸、碱、盐的性质实验时,发现实验台上摆放的药品中有一个装溶液的试剂瓶未盖瓶盖且标签破损(如图),于是决定对这瓶溶液进行实验探究:
某校兴趣小组同学准备进行常见的酸、碱、盐的性质实验时,发现实验台上摆放的药品中有一个装溶液的试剂瓶未盖瓶盖且标签破损(如图),于是决定对这瓶溶液进行实验探究:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
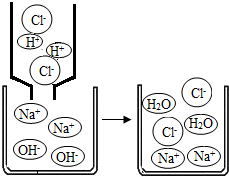
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
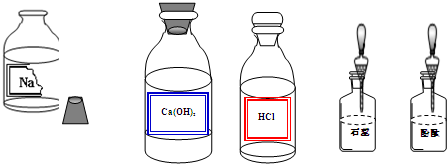
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
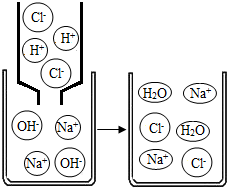
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com