
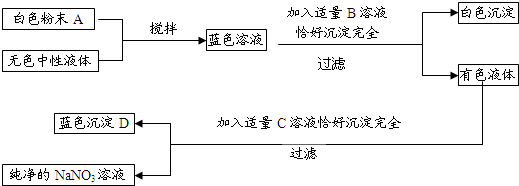
分析 根据无水硫酸铜是白色固体,其溶于水后得到蓝色溶液,可以判断A为硫酸铜,无色中性液体可以是水或是强酸强碱盐的溶液,有色溶液和C反应后生成了硝酸钠和蓝色沉淀,故可以判断有色溶液为硝酸铜,而蓝色沉淀D为氢氧化铜,故C为氢氧化钠溶液,而B为硝酸钡,至此分析完毕,带入验证能够证明推断正确,故可以据此答题.
解答 解:(1)根据无水硫酸铜是白色固体,其溶于水后得到蓝色溶液,可以判断A为硫酸铜,无色中性液体可以是水或是强酸强碱盐的溶液,有色溶液和C反应后生成了硝酸钠和蓝色沉淀,故可以判断有色溶液为硝酸铜,而蓝色沉淀为氢氧化铜,故C为氢氧化钠溶液,而B为硝酸钡;
(2)无色中性液体为纯净物,所以可以判断A为水;
(3)根据题意分析可知无色中性溶液A为强酸强碱盐,且不和硫酸铜反应,所以可以判断A为硫酸钠、硝酸钠或是氯化钠,当然也可以是相应的钾盐;
(4)根据转化可知,生成白色沉淀的反应为硫酸铜和硝酸钡的反应,故可以写出其反应的化学方程式CuSO4+Ba(NO3)2═BaSO4↓+Cu(NO3)2.
(5)硫酸铜溶液与氢氧化钠溶液反应生成蓝色沉淀的化学反应方程式为CuSO4+2NaOH═Na2SO4+Cu(OH)2↓.
故答案为:
(1)Ba(NO3)2;NaOH;Cu(OH)2;
(2)H2O;
(3)Na2SO4;NaNO3;
(4)CuSO4+Ba(NO3)2═BaSO4↓+Cu(NO3)2;
(5)CuSO4+2NaOH═Na2SO4+Cu(OH)2↓
点评 本题考查框图题中物质的推断,能够综合考查学生解决问题的能力,解答该类题目关键是找出解题的突破口,然后顺藤摸瓜顺推或是逆推,得出各物质的组成,然后带入验证,能够自圆其说即可.


科目:初中化学 来源: 题型:选择题
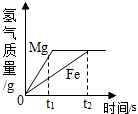 将等质量的镁和铁分别放入等质量、等溶质的质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是( )
将等质量的镁和铁分别放入等质量、等溶质的质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是( )| A. | 反应结束后镁有剩余 | |
| B. | 反应消耗盐酸的总质量相等 | |
| C. | 0~t1时段,与镁反应的HCl的质量大 | |
| D. | 0~t2时段,参加反应的镁的质量与铁相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某教师设计的创新实验装置图如图,请完成下列探究:
某教师设计的创新实验装置图如图,请完成下列探究:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | Cu(CuO) | 足量稀硫酸 | 过滤、洗涤、干燥 |
| B | NaCl(KNO3) | 水 | 溶解、降温结晶、过滤 |
| C | NaCl(MgCl2) | 过量NaOH溶液 | 过滤、蒸发结晶 |
| D | CO2(CO) | 足量O2 | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
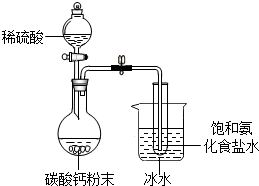 某化学兴趣小组在学习了候氏联合制碱法后,运用下图实验装置和其他实验设备成功制得了纯碱--碳酸钠.
某化学兴趣小组在学习了候氏联合制碱法后,运用下图实验装置和其他实验设备成功制得了纯碱--碳酸钠.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 90% | B. | 95% | C. | 80% | D. | 70% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气中氧气的体积分数是21% | |
| B. | 海洋中繁衍着无数的水生生物.含有100多种化学元素 | |
| C. | “西气东输”输送的是液化石油气 | |
| D. | 地壳中含量最多的金属元素是铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com