注射器是一种普通的医疗器械,但它在化学实验装置和习题中出现越来越多,它对某些实验现象的观察或实验过程的改进起到了意想不到的效果.
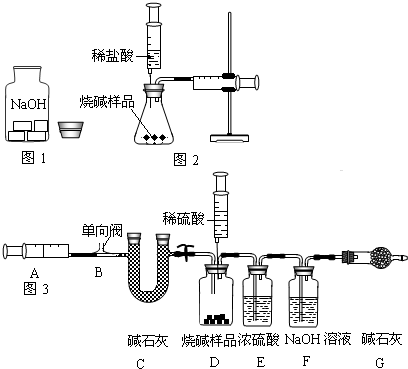
(1)图1用50mL试管作反应容器,磷的燃烧均在密闭容器里进行,可防止白烟污染空气.
实验目的:用50mL注射器(活塞事先处在20mL刻度处)测量磷燃烧消耗氧气的体积.
操作:①检查装置的气密性.②装药品,连好仪器.③夹紧弹簧夹,加热白磷,观察试管中所发生现象为
.④燃烧结束,试管冷却后打开弹簧夹,可以看到活塞慢慢左移到约
mL刻度处(取整数值).说明空气中氧气的体积分数约为
.
(2)图2用推拉注射器活塞的方法可以检查装置的气密性.当缓缓向外拉动活塞时,如果装置气密性良好,则能观察到(
)
A.注射器内有液体;B.瓶中液面上升;C.长颈漏斗内液面上升;D.长颈漏斗下端管口产生气泡.
(3)兴趣小组走进实验室看到了一个不和谐的“音符”(如图3).
( I)此情此景你首先想到是取用该药品时试剂瓶瓶塞应
放在桌上;取用后应立即塞上瓶塞密封保存,这是因为
,
.
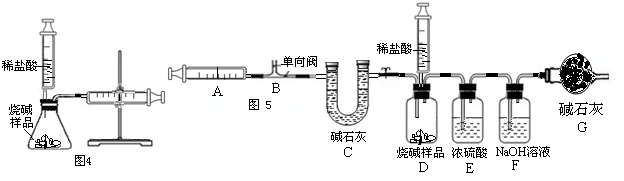
(II)该兴趣小组同学为了测定某变质的烧碱样品中Na
2CO
3的质量分数,首先设计了图4所示的装置,通过反应后右侧注射器内收集到气体的量计算出Na
2CO
3的质量分数(已知该状态下CO
2的密度,所使用注射器最大量程为20mL).写出锥形瓶内所发生变化的化学方程式:
;
.
小张认为该方案不能准确测得Na
2CO
3的质量分数,这是因为
,且小李认为该方案中样品的取用的量也需要一定的控制,这是因为
.
(III)该兴趣小组同学在反思上面实验后设计了如图5的装置测定变质的烧碱样品中Na
2CO
3的质量分数.反应的开始、结束都要用注射器反复的排送气体.实验步骤为:
①检查装置的气密性. ②称取10克干燥的烧碱样品放入广口瓶中,D处注射器内加入适量的稀硫酸,准确称量装置F的质量320克,连好装置. ③打开弹簧夹1,反复推拉注射器A 10次,准确称量装置F的质量320.5克.④关闭弹簧夹1,然后推动活塞,让稀硫酸逐滴滴入样品中,直到不再产生气泡为止. ⑤打开弹簧夹1,缓缓推拉注射器A 10次. ⑥再准确称装置F质量为321.6克.
问题探究:
(i)E装置的作用是
,G装置的作用
.
(ii)若步骤⑤中注射器推拉速率过快,则测定的Na
2CO
3的质量分数会
(填“偏大”、“偏小”、“不变”).
(iii)试根据实验所记数据计算出该烧碱样品中Na
2CO
3的质量分数
(不要求些计算过程).



 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案