
【题目】已知:2CO2+2Na2O2═2Na2CO3+O2.在密闭容器中,将 6.6g CO2 与一定量的 Na2O2固体充分反应后,气体变为3.8g.下列说法正确的是( )
A. 3.8g气体全部是O2
B. 剩余CO2的质量是2.2g
C. 反应后的固体是混合物
D. 生成Na2CO3的质量是15.9g
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E均为初中化学常见的物质,且均含一种地壳中含量最多的元素,其中A是单质;B、C在常温下均为液体且组成元素相同;E在常温下为气体,能使澄清石灰水变浑浊;反应①中出现火星四射现象) 。它们之间存在如图所示的转化关系 (图中“![]() ”表示转化关系,其中的反应条件已略去).
”表示转化关系,其中的反应条件已略去).

请回答下列问题:
(1)B的化学式为___________,E的化学式为___________
(2)请写出下列变化的符号表达式,并注明基本反应类型
①_______ ________________
②_____________ _______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~F是初中化学中的常见物质,如图所示是它们之间的转化关系,图中部分反应物或生成物未全部标出。已知:A是天然气的主要成分,B在常温下为液态,F是黑色粉末。

(1)写出A、B物质的化学式 _________、________;
(2)B→D是_______反应(填“放热”或“吸热”);
(3)反应①的化学方程式为___________________________________________;
(4)反应④的化学方程式为___________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常用如图装置测定空气中氧气的含量。
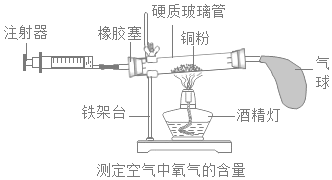
(实验原理)该实验反应的原理是______(用方程式表示)。
(实验步骤)具体实验步骤有:
①在硬质玻璃管中装入铜粉,两端塞上带导管的橡皮塞,其中一端用气球密封;
②测量出实验所用硬质玻璃管的容积;
③停止加热后,待试管冷却至室温,注射器活塞稳定后,记录注射器中气体的体积;
④酒精灯在铜粉部位加热,加热时不断推拉注射器:
⑤移动注射器活塞,在注射器中留下一定体积的气体,记录体积后与硬质玻璃管另一端密封连接,并将硬质玻璃管固定在铁架台上。
(1)正确的操作步骤为______(填数字序号);
(2)在实验加热过程中,硬质玻璃管中观察到的现象是______;缓慢推拉注射器活塞的目的是______;
(实验记录)如表是甲、乙、丙三组同学记录的实验数据:
实验 小组 | 硬质玻璃管的容积/mL | 反应前注射器中气体体积/mL | 反应后注射器中气体体积/mL | 反应消耗的氧气体积/mL | 空气中氧气的体积分数(%) |
甲 | 45 | 15 | 4 | 11 | 18.3 |
乙 | 40 | 18 | 5 | 13 | 22.4 |
丙 | 50 | 20 | 6 | ______ | ______ |
填写上表中空白,帮助丙组同学完成实验数据的统计;
(实验分析)从上述数据中可知,该实验存在一定误差,导致该实验数据比21%小的原因不可能是______(填数字序号)。
①没有缓缓推拉注射器活塞;
②读数时没有冷却至室温;
③加入铜丝量太多;
④反应后读数时小气球中气体未全部挤出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了探究碳酸钙与稀盐酸的接触面积对反应速率的影响,某化学兴趣小组的同学进行了如下实验。
(进行实验)按图所示的装置进行实验,倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,测定瓶内的气压随时间的变化如图所示。
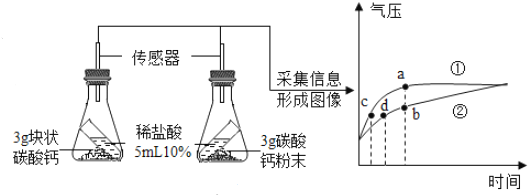
(实验分析)(1)碳酸钙与稀盐酸反应的化学方程式为_____。
(2)对比分析![]() 、
、![]() 两点可知,______曲线表示粉末状碳酸钙和稀盐酸反应;对比分析
两点可知,______曲线表示粉末状碳酸钙和稀盐酸反应;对比分析![]() 、
、![]() 两点可知,相同气压时,_____(选填“粉末状”或“块状”)碳酸钙与稀盐酸反应速率更快。
两点可知,相同气压时,_____(选填“粉末状”或“块状”)碳酸钙与稀盐酸反应速率更快。
(3)由图可知,碳酸钙粉末产生的CO2____(选填“大于”“小于”或“等于”)块状碳酸钙产生的CO2。
(实验结论)碳酸钙与稀盐酸的接触面积越大,反应速率越快。
(4)还有哪些因素影响碳酸钙与稀盐酸反应的快慢,请提出猜想,并设计实验方案进行验证。
猜想:______;
实验方案______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验室用于气体制备的装置,请根据图示回答问题
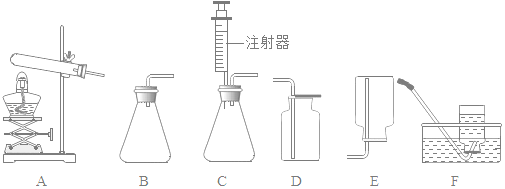
(1)实验室用氯酸钾制取氧气应选择的发生装置是______(填序号,下同)。
(2)实验室中能用于过氧化氢溶液制氧气,且便于随时添加液体药品的发生装置是______;要想得到比较纯净的氧气,需要选择的收集装置是______。
(3)实验室制取二氧化碳时,化学反应原理是______(用化学反应方程式表示);应选择的收集装置是______,理由是______;判断二氧化碳是否收集满的方法是______,是否为二氧化碳的方法是______(用化学反应方程式表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是水的电解实验装置图.
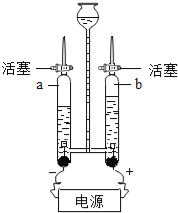
(1)该实验中,与两个电极相连的a、b两支玻璃管中产生的气体分别是 和 ,体积比约为 .
(2)该实验证明了水是由 组成的.
(3)下列行为,不利于保护水资源的是 (填序号).
A.工业用水重复使用 |
B.大量使用化肥和农药 |
C.加强城市污水处理系统的建设 |
D.用喷灌方法给农作物浇水 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B两种物质的溶解度曲线。请回答:
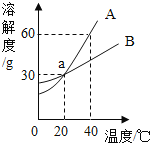
(1)在40℃时A、B的溶解度大小关系是________________。
(2)a点是A、B两条曲线的交点,其含义是____________________________。
(3)20℃时将20gA固体放人50g水中,充分溶解后,所得溶液的质量是__________g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化肥由(NH4)2SO4,K2SO4、KCI混合而成,对提高农作物产量有重要作用。
(1)该化肥施用后,能使植物_____(填序号)
A.茎叶生长茂盛 B.增强抗寒抗旱能力 C.增强抗倒伏,抗虫害能力
(2)(NH4)2SO4中N、O两元素的质量比为_____(化成最简比)
(3)为测定该化肥样品中氮元素的质量分数,小民和小青分别按自己设计的方案进行了实验。
方案1:小民取10.0g样品溶于水,加入足量的BaCl2溶液,充分反应后,过滤、洗涤、干燥、称量得固体质量为16.5g
方案2:小青另取等质量的样品,加入足量的Ca(OH)2加热,将气体通过氢氧化钠固体和浓硫酸,氢氧化钠固体增重1.8g,浓硫酸增重1.7g(假设气体全部吸收)。
用方案1计算出的氮元素的质量分数偏大,简述理由_____。
用方案2计算该化肥样品中氮元素的质量分数数(请在答题纸上写出计算过程)。___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com