
| A. |  氢气验纯 | B. |  闻气体气味 | C. |  检查气密性 | D. |  取固体药品 |
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 它是一种氧化物 | |
| B. | 组成中含有地壳中含量最多的金属元素 | |
| C. | 它是一种化合物 | |
| D. | K2FeO4中铁元素的化合价为+3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
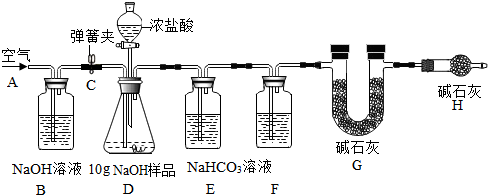
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
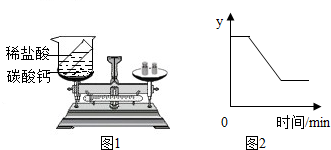 根据质量守恒定律,回答下列问题.Ⅰ、为验证质量守恒定律,某同学设计了如图的实验.
根据质量守恒定律,回答下列问题.Ⅰ、为验证质量守恒定律,某同学设计了如图的实验.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
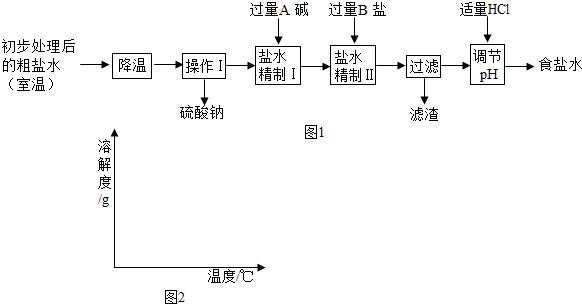
| 实验操作 | 实验现象 | 实验结论 |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com