
| A. | H+、Cl-、Ba2+、CO32- | B. | Ag+、I-、K+、NO3- | ||
| C. | K+、OH-、Cl-、Na+ | D. | Fe3+、Cl-、NO3-、Na+ |
分析 根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存;本题还要注意能得到无色透明溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.
解答 解:A、H+、CO32-两种离子能结合成水和二氧化碳,不能大量共存,故选项错误.
B、Ag+、I-两种离子能结合成碘化银沉淀,不能大量共存,故选项错误.
C、四种离子间不能结合成沉淀、气体或水,能大量共存,且不存在有色离子,故选项正确.
D、四种离子间不能结合成沉淀、气体或水,能大量共存,但Fe3+的水溶液显黄色,故选项错误.
故选:C.
点评 本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意特定离子的颜色.


科目:初中化学 来源: 题型:解答题
 以下是甲、乙两同学对有关镁与盐酸反应的系列研究.
以下是甲、乙两同学对有关镁与盐酸反应的系列研究.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 把木炭放入冰箱中,冰箱异味消失 | |
| B. | 夏天吃雪糕时,发现雪糕慢慢融化 | |
| C. | 用小刀削苹果皮后,一会儿表面呈黄色 | |
| D. | 工业上用分离液态空气制取氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
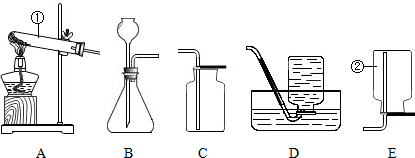
 结合如图所示的实验装置,回答下列问题.
结合如图所示的实验装置,回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
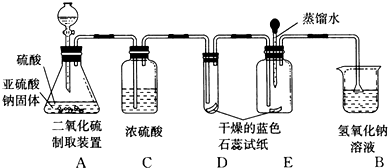
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com