

| ||
| ||


科目:初中化学 来源: 题型:
| A、反应所消耗的硫酸质量相等 |
| B、反应产生的硫酸盐溶液的溶质的质量分数相等 |
| C、反应消耗的三种金属的质量相等 |
| D、反应消耗的铁、镁、铝质量比为28:12:9 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、醋酸与KOH溶液反应 |
| B、稀硫酸与Ba(OH)2溶液反应 |
| C、NaHSO4溶液与NaOH溶液反应 |
| D、盐酸与氨水反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
| B、Ca(ClO)2+2CO2+2H2O═Ca(HCO3)2+2HClO |
| C、2ClO-+CO2+H2O═CO+2HClO |
| D、NaClO+CO2+H2O═NaHCO3+HClO |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
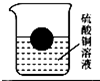 如图所示,将一个塑料小球放入盛有硫酸铜溶液的烧杯中,小球漂浮于液面,将足量的铁粉投入到烧杯中,充分反应后,观察到铁粉表面有红色物质析出,写出有关反应的化学方程式
如图所示,将一个塑料小球放入盛有硫酸铜溶液的烧杯中,小球漂浮于液面,将足量的铁粉投入到烧杯中,充分反应后,观察到铁粉表面有红色物质析出,写出有关反应的化学方程式查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属 | 铁 | 锰 |
| 与盐酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 |
| 得出结论 | 比较金属活动性:铁 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com