
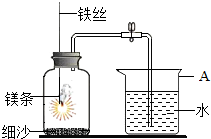
 某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验.在空气中点燃镁条(足量),插入密闭的集气瓶中,镁条熄灭后,待冷却至室温后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%
某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验.在空气中点燃镁条(足量),插入密闭的集气瓶中,镁条熄灭后,待冷却至室温后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%分析 (1)根据当集气瓶中的气体减少时,会导致压强减小分析;
(2)根据空气中氧气的体积分数可得出氧气的最大含量;氮气减少的原因除与镁反应外,还可能与集气瓶中的其他物质反应;
【查阅资料】①在化合物中,化合价的代数之和为0,可计算出氮化合价;根据信息写出镁燃烧的两个方程式;
②根据镁条还可以在二氧化碳气体中燃烧,生成碳和氧化镁结合方程式的书写方法写出反应的方程式;
(3)可以从燃烧的定义、支持镁燃烧的物质、反应基本类型等来认识燃烧.
解答 解:(1)燃烧、冷却后打开止水夹,水能进入集气瓶中的原因是:集气瓶内气体被消耗,导致压强减小,在大气压的作用下,水压入集气瓶.
故答案为:集气瓶中气体减少,压强减小,导致烧杯中的水进入集气瓶;
(2)如果只和空气中氧气反应那么不会超过21%,因为空气中氧气占21%;空气中氧气的体积分数约为21%,故通过实验测得空气中氧气的体积分数最多不会超过21%;
氮气除与镁反应外,还可能与集气瓶中的其它物质反应(如氮气与铁丝发生反应而减少或氮气与瓶内的其它物质反应而减少等)
故答案为:21%;氮气与瓶内的其他物质反应而减少;
①设氮元素的化合价为x,根据化合价的原则列等式(+2)×3+2x=0 解得x=-3;根据题意可知氮气与氧气反应产生氧化镁,与氮气反应产生氮化镁,反应的方程式分别为:2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2MgO;3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
故答案为:-3; 2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2MgO;3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
②根据题意,镁条还可以在二氧化碳气体中燃烧,生成碳和氧化镁,反应的方程式为:2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
故答案为:2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(3)由镁不仅能在氧气中燃烧,也能在二氧化碳、氮气中燃烧,故可以得出燃烧不一定有氧气参加反应;根据镁与二氧化碳反应的化学方程式可以看出燃烧可以是置换反应;二氧化碳能支持镁的燃烧,故可以得出二氧化碳不但能灭火,还能在一定条件下支持燃烧等.
故答案为:燃烧不一定需要氧气(合理即可).
点评 本题以课本中“用红磷燃烧来探究空气中氧气含量”为基点,换成“镁在空气中燃烧”的实验探究,激发了学生的知识的灵活使用和知识的迁移转换的思想,达到举一反三的效果.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 做化学实验时,取出的多余药品应放回到原试剂瓶中,避免浪费 | |
| B. | 易燃、易爆药品与有强氧化性的物质要分开放置并远离火源 | |
| C. | 不慎将酒精灯碰倒,洒出的酒精在桌上燃烧起来,立刻用湿布扑灭 | |
| D. | 不慎将氢氧化钠溶液沾到皮肤上,立即用大量水冲洗,再涂上硼酸溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 观察气体颜色 | B. | 观察它们各自在水中溶解性 | ||
| C. | 用燃着木条分别伸入瓶中 | D. | 用紫色石蕊试液检验 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com