
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2990 | 2750 | -- |
分析 (1)根据元素周期表中一个格的含义和原子结构示意图的意义分析回答;
(2)根据相对原子质量=质子数+中子数分析.
(3)根据铝的性质分析.
(4)根据物质的组成分析类别;
(5)根据金属活动性顺序表的应用分析;
(6)当金属铁呈液态时,由于金属铝的熔点比铁低,所以金属铝也是液态;
(7)根据化合价原则求出元素的化合价;
(8)根据碳燃烧生成了二氧化碳分析回答;
(9)根据铝与硫酸的反应写出反应的化学方程式;
(10)①据信息:二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物水,据此书写方程式;
②根据方程式中元素守恒来确定物质.
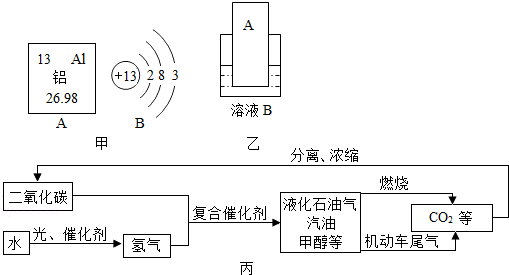
解答 解:(1)由元素周期表中铝元素的信息可知,其相对原子质量为26.98.由铝的原子结构示意图可知,最外层电子数是3,小于4,化学反应中该原子容易失去电子;
(2)相对原子质量=质子数+中子数,则Al-30的中子数为:30-13=17.
(3)铝制品在生活中因耐用而应用越来越广泛,主要原因是:常温下,铝制品表面会有一层致密的氧化膜,阻止铝进一步被氧化.
(4)运载“嫦娥三号”的火箭外壳用到了钛合金,钛合金属于混合物.
(5)要通过图乙实验得出铝和铜的金属活动性顺序,如果B是硫酸铜溶液,则金属A是Al,如果A是铜,则溶液B中溶质的名称是硫酸铝等.
(6)根据表中的数据可以看出,金属铝的熔点点比铁低,当金属铁是液态时,金属铝也是液态,所以铝热反应得到的是金属铁和金属铝的混合物;
(7)在FeTiO3中,铁显+2价,氧显-2价,可推出中钛(Ti)的化合价是+4价;
(8)石墨烯的主要成份是碳,在空气中完全燃烧生成了二氧化碳,化学反应方程式为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
(9)由于烯合金中含有铝,铝能与稀硫酸反应生成了氢气和硫酸铝,该反应的化学方程式是:2Al+3H2SO4=Al2(SO4)3+3H2↑,
(10)①根据信息:二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,根据元素守恒,该物质即为水,方程式为:CO2+3H2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CH4O+H2O;
②根据质量守恒定律,化学反应前后原子的种类和数目不变,反应前C、O原子个数是1、2;反应后C、O、N、H原子个数是1、2、2、6,故物质x的化学式为NH3.
故答案为:(1)26.98;失去电子;(2)17;(3)常温下,铝制品表面会有一层致密的氧化膜,阻止铝进一步被氧化.(4)混合物.(5)Al,硫酸铝等.(6)该反应温度下铝已熔化,未反应的铝与生成的铁熔合在一起;(7)+4价;(8):C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.(9):2Al+3H2SO4=Al2(SO4)3+3H2↑,
(10)①:CO2+3H2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CH4O+H2O;②NH3.
点评 本题所考查的知识点较多,但难度不大,属于基础的知识,加强有关基础知识的学习,才能较快的完成本题.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
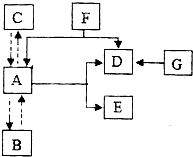 如图所示.A、B、C是水循环的三种自然状态.A为密度最大时的状态.D具有助燃性和氧化性.能与许多物质发生剧烈地、或缓慢地氧化反应.G是白色固体,加热时分解生成D和另一种固体.图中“→”表示物质间A存在转化关系;反应条件、部分反应物和生成物已略去.试回答下列问题.
如图所示.A、B、C是水循环的三种自然状态.A为密度最大时的状态.D具有助燃性和氧化性.能与许多物质发生剧烈地、或缓慢地氧化反应.G是白色固体,加热时分解生成D和另一种固体.图中“→”表示物质间A存在转化关系;反应条件、部分反应物和生成物已略去.试回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| ①将易拉罐口打开,迅速用燃着的木条伸入罐口. | 发出“噗”的一声,产生淡蓝色火焰,片刻后熄灭. | 说明罐中重新生成的气体A是氢气(H2). |
| ②取少量铝片于试管中,先加入适量的水,片刻后再加入少量的氢氧化钠溶液. | 先加水,没有明显变化,后加入氢氧化钠溶液后产生无色无味的气体. | 说明铝是否与水直接反应:否(填“是”或“否”),铝能够与NaOH(碱性)溶液反应. |
| ③取少量易拉罐中反应后的溶液于试管中,加入过量的稀盐酸. | 产生了无色无味气体,该气体能使澄清石灰水变浑浊. | 说明原CO2气体被NaOH溶液吸收. |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | KClO3 | 580 |
| ② | KClO3、MnO2(质量比1:1) | 350 |
| ③ | KClO3、CuO(质量比1:1) | 370 |
| ④ | KClO3、Fe2O3(质量比1:1) | 390 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只有③ | B. | ②③ | C. | ③⑤ | D. | ①④ |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ③②①④⑥⑤⑦ | B. | ②③④①⑤⑦⑥ | C. | ②③④①⑤⑥⑦ | D. | ③②①④⑤⑥⑦ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com