【答案】
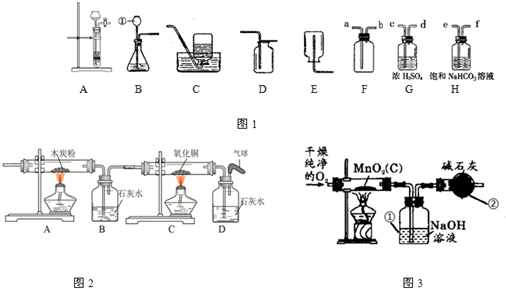
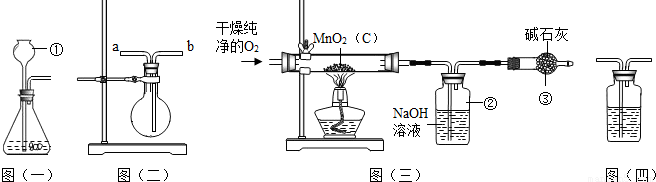
分析:(1)该图的发生装置适用天固体与液体在常温下反应制取气体,所以用该装置制取氧气时应选择过氧化氢分解的反应进行氧气的制取;
(2)分析特别装置的使用方法,说明使用该装置进行排水收集气体的连接方法;
(3)碱石灰为氢氧化钠和氧化钙的混合物,既能吸收水分也能吸收空气中的二氧化碳;
(4)检验混合气体是否还含有二氧化碳,所以选择现象明显的石灰水;
(5)分析装置质量差出现的原因,得出二氧化碳的质量,根据变化前后元素质量不变,求出混合粉末中木炭质量,再计算二氧化碳质量,最后用二氧化碳质量与混合粉末质量比,求出粉末中二氧化锰的质量分数.
解答:解:(1)过氧化氢分解制取氧气所需的药品有:过氧化氢和二氧化锰;反应生成水和氧气;
故答:H
2O
2、MnO
2;2H
2O
2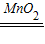
2H
2O+O
2↑
(2)排水法收集气体,是利用生成的气体使装置内压强升高而把水从瓶中排出;气体聚集在容器上部,a端进气使气体无法逸出而瓶内压强增大,水从b端排出;
故选A,b;
(3)碱石灰既可以吸收水分也可以吸收二氧化碳气体;为防止氢氧化钠溶液吸收空气中二氧化碳影响探究结果,因此在本装置中,增加装有碱石灰的干燥管③,用来吸收空所中二氧化碳,减少对实验结果的影响;
故答:吸收空气中的二氧化碳
(4)为检验装置②中排出气体是否含有二氧化碳以检验二氧化碳被完全吸收,可在装置②与③之间加入澄清石灰水,澄清石灰水不变浑浊,可以说明二氧化碳被全部吸收;
故选B;
(5)图㈢中用来吸收产生的二氧化碳的装置②反应前后的质量差为1.1 g,
所以增重的量即为吸收的二氧化碳的量,即吸收了二氧化碳质量为1.1g,
其中含C元素质量=1.1g×
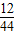
×100%=0.3g,即混合粉末中含有0.3g木炭粉,
则含有黑色二氧化锰的质量分数=
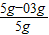
×100%=94%
故答:94%.
点评:分析探究过程中各装置的作用,理清探究思路,根据探究思路逐步进行分析,找出符合探究思路的解决问题的方法.

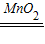 2H2O+O2↑
2H2O+O2↑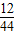 ×100%=0.3g,即混合粉末中含有0.3g木炭粉,
×100%=0.3g,即混合粉末中含有0.3g木炭粉, ×100%=94%
×100%=94%