
人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。请回答:
(1)地壳中含量最多的金属元素是________;
(2)根据下图的应用实例,试说出金属具有的两点物理性质:________、________;

(3)早在春秋战国时期,我国古代人民已经开始炼铁:
①写出磁铁矿(Fe3O4)与CO反应的化学方程式:________________________;
②钢铁防腐十分重要!请写出一种防止钢铁生锈的方法:________________________。
科目:初中化学 来源:2019年4月山东省潍坊市高密市中考一模化学试卷 题型:单选题
下列各种溶质的溶液混合后无明显现象的一组是
A. HCl、Na2CO3、 K2SO4 B. KNO3、Ba(OH)2、 NaCl
C. KCl、AgNO3、HNO3 D. NaOH、FeCl3、(NH4)2SO4
查看答案和解析>>
科目:初中化学 来源:江苏省徐州市2014届九年级上学期期末化学试卷 题型:科学探究题
我国是一个钢铁大国,钢铁产量为世界第一。某化学实验小组的同学用下面的装置在实验室中模拟炼铁。请你和他们一起完成相关探究。
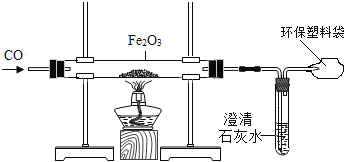
(1)操作顺序是实验成败的关键,对于该实验,应______________________(填“先通入一氧化碳”或“先点燃酒精灯”)。
(2)反应中可观察到粗玻璃管内的固体逐渐由_________色变成__________色,写出该反应的化学方程式____________________。
(3)产物的检验:
①初步检验:甲同学想对反应后的产物进行初步检验,请你帮他想出一个物理方法:____。
②进一步验证:乙同学想用化学方法对产物进一步验证,他将反应后的黑色粉末加入足量的硫酸铜溶液中,发现只有部分变红。请写出生成红色物质的化学方程式:_____。
(4)质疑与探究:
①乙同学对产物的成分产生了质疑,查阅相关资料之后得知,一氧化碳还原氧化铁是一个逐渐的过程。
首先是Fe2O3被还原为Fe3O4:3Fe2O3 + CO 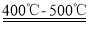 2Fe3O4 + CO2。
2Fe3O4 + CO2。
然后是Fe3O4被还原为FeO:______ ______。
______。
最后是FeO被还原为Fe:FeO + CO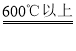 Fe + CO2
Fe + CO2
②通过以上分析,甲乙两位同学对反应后黑色固体的成分进行了猜想:
已知:FeO、Fe3O4均为黑色,且Fe3O4有磁性。FeO、Fe3O4都不与硫酸铜溶液反应。
猜想一:Fe与Fe3O4; 猜想二:Fe与FeO; 猜想三:Fe与Fe3O4和FeO。
③为了对产物固体的成分进行更客观的分析,甲乙同学将所做实验整理如下:
实验内容 | 实验现象 | 实验结论 |
将反应后得到的黑色粉末 用磁铁吸引 | ________ | 猜想一 成立 |
将反应后得到的黑色粉末 加入足量的硫酸铜溶液中 | ________ |
④实验反思:为了提高铁的产率,应适当________(填“降低”或“提高”)反应温度。
查看答案和解析>>
科目:初中化学 来源:福建省厦门市集美分校2019-2020学年九年级下学期3月线上月考化学试卷 题型:计算题
赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
(1)Fe2O3中氧元素的质量分数为______。
(2)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为2Fe2O3+C 4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,如图所示为固体混合物的质量随反应时间的变化曲线。
4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,如图所示为固体混合物的质量随反应时间的变化曲线。
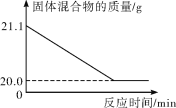
①由图可知:生成CO2气体的质量为______g。
②计算反应后固体混合物中FeO的质量分数______ (请根据化学方程式写出完整的计算步骤)。
查看答案和解析>>
科目:初中化学 来源:福建省厦门市集美分校2019-2020学年九年级下学期3月线上月考化学试卷 题型:单选题
重铬酸钾(K2Cr2O7)可用于测定酒驾中的酒精(C2H5OH)含量。下列说法正确的是
A.K2Cr2O7中铬元素的化合价为+7
B.K2Cr2O7属于氧化物
C.C2H5OH的相对分子质量为46
D.C2H5OH中C.H.O的原子个数比为2:5:1
查看答案和解析>>
科目:初中化学 来源:福建省厦门市集美分校2019-2020学年九年级下学期3月线上月考化学试卷 题型:单选题
下列物质加入水中,不能形成溶液的是
A.蔗糖 B.硝酸钾 C.植物油 D.高锰酸钾
查看答案和解析>>
科目:初中化学 来源:广东省佛山市顺德学校2019-2020学年九年级下学期第二次月考化学试卷 题型:单选题
下列有关化学用语表示正确的是( )
A.2 个氖原子:Ne2 B.氨分子: NH4+
C.2 个亚铁离子:2Fe2+ D.氧化镁中镁元素的化合价: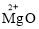
查看答案和解析>>
科目:初中化学 来源:人教版2020年九年级上学期第五单元第31课时 课题 3 利用化学方程式的简单计算(2)同步练 题型:计算题
某化学小组测量氢化钙(CaH2)样品中氢化钙的质量分数。取5g样品于锥形瓶中,加入100g水充分反应,称得锥形瓶内剩余物质的质量与反应时间的关系如图所示。假设杂质分布均匀且与水不发生反应,反应方程式为 ,请回答:
,请回答:

(1)反应生成的氢气质量为_______________;
(2)样品中氢化钙的质量分数为________。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com