
 将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,对于该图象的理解,下列说法正确的是①③(填序号).
将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,对于该图象的理解,下列说法正确的是①③(填序号).分析 ①根据锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短进行分析;
②由方程式分析可知:生成相等质量的氢气消耗的金属的质量不相等,据此分析;
③由图示可知:生成的氢气的质量相等,所以硫酸均反应完;
④由图示可知:生成的氢气的质量相等,所以硫酸均反应完,消耗的两种金属的质量一定不等;
⑤由图示可知:生成的氢气质量相等进行分析.
解答 解:①锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,故①正确;
②根据化学方程式Fe+H2SO4═FeSO4+H2↑,可知每56g铁生成2g氢气,根据化学方程式Zn+H2SO4═ZnSO4+H2↑,可知每65g锌反应生成2g氢气;由方程式分析可知,二者反应结束后,生成相等质量的氢气消耗的金属的质量不相等,可能金属都有剩余,也可能锌恰好反应完,铁有剩余,故②错误;
③置换反应是金属置换酸中的氢元素,所以若生成的氢气的质量相等,硫酸均反应完,故③正确;
④由方程式分析可知,二者反应结束后,生成相等质量的氢气消耗的金属的质量不相等,故④错误;
⑤由方程式分析可知,二者反应结束后,生成相等质量的氢气消耗的金属的金属不相等,所得溶液的质量一定不相等,故⑤错误.
故填:①③.
点评 本题结合图象对金属与酸的反应进行了细致的考查,能很好的考查学生对知识的掌握和应用能力,要结合相关知识认真分析.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:实验探究题
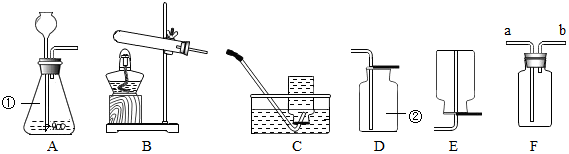
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
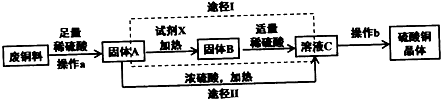
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
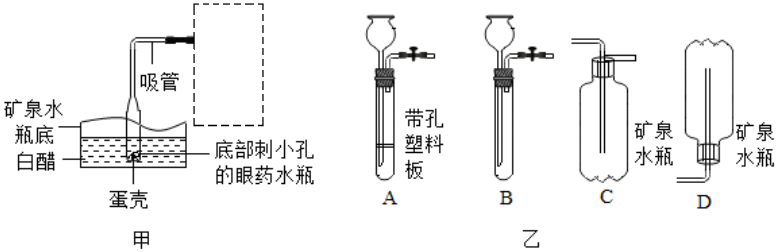
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 淀粉 | B. | 油脂 | C. | 蛋白质 | D. | 维生素 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 如图A-G是初中化学常见的物质,其中A为黑色固体,E为红色固体单质,B、C、D均为无色气体,F为石灰石的主要成分,G为蓝色溶液,请根据如图回答下列问题:(假设每个反应都恰好完全反应)
如图A-G是初中化学常见的物质,其中A为黑色固体,E为红色固体单质,B、C、D均为无色气体,F为石灰石的主要成分,G为蓝色溶液,请根据如图回答下列问题:(假设每个反应都恰好完全反应)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com