
| 温度/℃ | 20 | 40 | 60 | 80 | 100 | ||
| 溶解度 g/100g水 | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |


科目:初中化学 来源: 题型:
| 实验编号 | R的质量/g | 稀硫酸的体积/mL | 生成H2的体积/L |
| ① | 1.5 | 50.0 | 1.47 |
| ② | 2.0 | 50.0 | 1.96 |
| ③ | 2.2 | 50.0 | 2.16 |
| ④ | 2.5 | 50.0 | 2.16 |
| ⑤ | 3.0 | 50.0 | 2.16 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
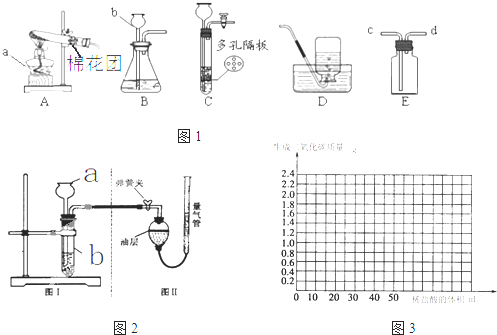
| ||
| ||
| ||
| ||
| 甲 | 乙 | |
| 实验过程 | 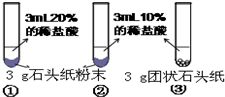 |
 |
| 现象 | 试管①、②、③中产生气泡快慢的顺序为: ①>②>③. |
|
| 分析结论 | Ⅰ碳酸钙与稀盐酸反应的化学方程式为 CaCO3+2HCl═2CaCl2+H2O+CO2↑ CaCO3+2HCl═2CaCl2+H2O+CO2↑ Ⅱ对比甲同学实验①②可知, 盐酸越浓(溶质的质量分数越大) 盐酸越浓(溶质的质量分数越大) ,化学反应的速度越快;Ⅲ对比甲同学实验 ②③ ②③ (填实验序号)可知,反应物的接触面积越大,反应速率越快 快 .Ⅳ乙同学的实验中,数据记录纸上应该连续记录的实验数据是 时间 时间 和锥形瓶及药品的质量或二氧化碳的质量 锥形瓶及药品的质量或二氧化碳的质量 . | |
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |


查看答案和解析>>
科目:初中化学 来源:101网校同步练习 初三化学 人教社(新课标2001年通过) 人教实验版 题型:022
下表是某市城市居民常用的气体燃料、价格和热值,通过分析回答下列问题:

(1)从经济角度考虑,选用哪种燃料更适合?________原因是________.
(2)实验证明,在同温、同压下,相同体积的任何气体中含有相同的分子数.根据此结论回答下列问题(以下气体均处在同温同压下)
①将同体积的CO(煤气的主要成分)和CH4(天然气的主要成分)混合,所得的混合气体中,碳、氢、氧元素的原子个数比为________,碳、氢元素的质量比为________(化成最简整数比).
②分别写出CO、CH4燃烧的化学方程式________、________
查看答案和解析>>
科目:初中化学 来源:化学教研室 题型:022
|
燃料 |
价格 |
热值 |
|
煤气 |
1.25元/Kg |
1.56×107/Kg |
|
石油液化气 |
2.50元/Kg |
4.5×107/Kg |
|
天然气 |
1.4元/Kg |
3.9×107/Kg |
(1)从经济角度考虑,选用哪种燃料更适合?________原因是________
(2)实验证明,在同温、同压下,相同体积的任何气体中含有相同的分子数。根据此结论回答下列问题(以下气体均处在同温同压下)
①将同体积的CO(煤气的主要成分)和CH4(天然气的主要成分)混合,所得的混合气体中,碳、氢、氧元素的原子个数比为________,碳、氢元素的质量比为________(化成最简整数比)________
②分别写出CO、CH4燃烧的化学方程式________、________
查看答案和解析>>
科目:初中化学 来源:化学教研室 题型:022
|
燃料 |
价格 |
热值 |
|
煤气 |
1.25元/Kg |
1.56×107/Kg |
|
石油液化气 |
2.50元/Kg |
4.5×107/Kg |
|
天然气 |
1.4元/Kg |
3.9×107/Kg |
(1)从经济角度考虑,选用哪种燃料更适合?________原因是________
(2)实验证明,在同温、同压下,相同体积的任何气体中含有相同的分子数。根据此结论回答下列问题(以下气体均处在同温同压下)
①将同体积的CO(煤气的主要成分)和CH4(天然气的主要成分)混合,所得的混合气体中,碳、氢、氧元素的原子个数比为________,碳、氢元素的质量比为________(化成最简整数比)________
②分别写出CO、CH4燃烧的化学方程式________、________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com