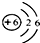解:(1)元素原子的最外层电子数决定了元素的性质,碳元素的化学性质与其原子的最外层电子数关系密切;
(2)A、碳是石字旁,属于非金属元素,故A说法正确;
B、原子序数=质子数,碳原子的原子序数是6,则其质子数是6,故B说法正确;
C、碳元素的原子结构示意图为图4,故C说法正确;
D、相对原子质量的单位为“1”,故D说法错误.
故选D.
(3)实验室中用大理石和稀盐酸反应,而大理石的主要成分为碳酸钙,可以据此写出该反应的化学方程式,实验室确定气体发生装置时应考虑反应物的状态和反应条件,所以若将该装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若装置的气密性好,则装置内会与外界隔绝,所以若能观察到漏斗颈中形成一段稳定的水柱(或液面不再下降),即可证明装置不漏气.
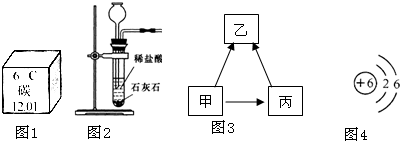
(4)根据甲和丙都能作为燃料,可以生成乙,并且乙能引起“温室效应”可以判断乙为二氧化碳,而乙和丙中所含的元素种类相同,所以丙为一氧化碳,又根据甲转化为乙的途径有多种,所以可以判断甲为碳单质,碳单质通过置换反应得到二氧化碳的反应通常为和金属氧化物的反应;一氧化碳和二氧化碳虽然组成元素相同,但是由于其原子的构成不同,所以它们的性质也有所不同.
(5)设50t含80%氧化铁的赤铁矿石最多能冶炼出铁的质量为X
Fe
2O
3+3CO

2Fe+3CO
2 160 112
50×80%t
=40t X

=
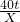
解得:X=28t
答:现用50t含80%氧化铁的赤铁矿石最多能冶炼出28吨铁.
故答案为:(1)最外层电子数;
(2)C、D;
(3)CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;反应物的状态和反应条件;漏斗颈中形成一段稳定的水柱(或液面不再下降);
(4)CO
2;2Fe
2O
3+3C

4Fe+3CO
2↑;两种物质的分子构成不同;
(5)28t.
分析:(1)元素原子的最外层电子数决定了元素的性质,,可以据此解答;
(2)根据元素周期表所表达的信息进行分析、判断;
(3)二氧化碳的实验制法来书写反应的化学方程式,根据实验室中选择制取气体装置的注意事项完成解答;
(4)根据甲和丙都能作为燃料,可以生成乙,并且乙能引起“温室效应”可以判断乙为二氧化碳,而乙和丙中所含的元素种类相同,所以丙为一氧化碳,又根据甲转化为乙的途径有多种,所以可以判断甲为碳单质,可以据此解答;
(5)根据氧化铁的质量结合化学方程式可以完成解答.
点评:此题综合考查了碳及碳的化合物的性质及计算,综合性强,要求学生熟练掌握基础知识才能很好的解答本题.

 2Fe+3CO2
2Fe+3CO2  =
=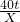
 4Fe+3CO2↑;两种物质的分子构成不同;
4Fe+3CO2↑;两种物质的分子构成不同;

 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容. 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容. D.碳的相对原子质量为12.01
D.碳的相对原子质量为12.01
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.