解:(1)a.钢是含碳量为0.03%~2%的铁合金,而不是纯铁;故a不正确;
b.金属材料包括金属单质和合金,钢是铁的合金,钢属于金属材料;故b正确;
c.钢是含碳量为0.03%~2%的铁合金,而生铁含碳量为2%~4.3%,钢的含碳量比生铁低;故c不正确;
(2)a.根据金属铝的活动性比铁强,则在相同时间内金属铝与稀硫酸反应放出氢气的速率大于铁;结合图示,可判断曲线①表示铝与硫酸的反应,曲线②表示铁与硫酸的反应;故a不正确;
b.根据27g铝粉完全反应可放出氢气的质量=
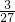
×27g=3g,而56g铁粉完全反应放出氢气的质量=
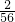
×56g=2g;结合图示可知反应结束后所得氢气质量相等,因此可判断反应结束后两金属粉末一定不会均完全反应;故b不正确;
c.若反应中稀硫酸质量不足完全反应而两金属都有剩余,则所得氢气质量一定相等,这种情况与图示所示结果一致,故c正确;
d.由于27g铝粉完全反应可放出氢气的质量大于56g铁粉完全反应放出氢气的质量,所以,当铁粉与稀硫酸恰好完全反应时,因27g铝粉完全反应需要更多的稀硫酸而出现稀硫酸不足铝粉剩余,此时稀硫酸完全反应所产生氢气的质量也会相等;此时所出现的情况与图示结果一致,故d正确;
(3)根据固体A与适量稀盐酸反应生成的混合溶液C呈浅绿色,可判断溶液C中一定含FeCl
2及另外的溶质,而溶液C与过量铝粉充分反应后所得溶液仍为混合溶液,可判断溶液C中另外的溶质中所含金属活动性比铝强,结合题中说明可判断该金属为镁;根据固体D灼烧可得到人体新陈代谢的产物G气体二氧化碳,可判断固体D中含有单质碳,再由黑色固体H能与稀硫酸反应生成蓝色硫酸铜溶液I,可判断固体D中含有铜;
综合以上分析,可判断固体A中含铁、镁、铜、碳;反应①为2Al+3FeCl
2=2AlCl
3+3Fe;反应②为CuO+H
2SO
4=CuSO
4+H
2O;
故答案为:(1)b;(2)cd;(3)C、Cu、Fe、Mg;2Al+3FeCl
2=2AlCl
3+3Fe;CuO+H
2SO
4=CuSO
4+H
2O.
分析:(1)根据生铁和钢的组成与分类:钢是含碳量为0.03%~2%的铁合金,而生铁含碳量为2%~4.3%;生铁和钢都属于金属材料;完成判断对钢的判断;
(2)根据一定质量的铝与铁完全反应放出氢气的质量及两金属的活动性,完成对问题的判断.27g铝粉完全反应可放出氢气的质量=
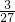
×27g=3g,而56g铁粉完全反应放出氢气的质量=
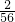
×56g=2g;金属铝的活动性比铁强,与酸反应放出氢气的速率大于铁;
(3)由气体G是人体新陈代谢的产物可判断该气体为二氧化碳;由溶液C为浅绿色可判断溶液C中含亚铁离子;由固体D灼烧可生成二氧化碳可判断D含单质碳;由溶液I呈蓝色可判断溶液中含铜离子;根据这些特殊现象,采取逆推的方法可判断固体粉末A的组成;推断中,还要注意反应①加入了过量的铝粉这一特别条件.
点评:解答本题时需要清醒地认识到,题中各小问题之间没有任何思维关联,因此不可搅在一起无谓添加思维难度.




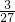 ×27g=3g,而56g铁粉完全反应放出氢气的质量=
×27g=3g,而56g铁粉完全反应放出氢气的质量=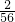 ×56g=2g;结合图示可知反应结束后所得氢气质量相等,因此可判断反应结束后两金属粉末一定不会均完全反应;故b不正确;
×56g=2g;结合图示可知反应结束后所得氢气质量相等,因此可判断反应结束后两金属粉末一定不会均完全反应;故b不正确;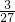 ×27g=3g,而56g铁粉完全反应放出氢气的质量=
×27g=3g,而56g铁粉完全反应放出氢气的质量=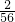 ×56g=2g;金属铝的活动性比铁强,与酸反应放出氢气的速率大于铁;
×56g=2g;金属铝的活动性比铁强,与酸反应放出氢气的速率大于铁;


 (2013?丰台区二模)金属材料在生产、生活中有着广泛的应用.
(2013?丰台区二模)金属材料在生产、生活中有着广泛的应用.