
科目:初中化学 来源: 题型:选择题
| 序号 | 实验操作(或方案) | 实验目的 |
| A | 取两块干燥的玻璃片,对着其中的一块哈气 | 比较呼出的气体和空气中水蒸气的含量 |
| B | 向试管中加入2mL浓氨水,将蘸有酚酞溶液的棉花靠近该试管的管口 | 证明分子在不断运动 |
| C | 把燃着的木条伸入充满氮气的集气瓶里 | 探究氮气是否支持燃烧 |
| D | 用排水法收集气体,当导管口有气泡放出时,立即将导管伸入盛满水的集气瓶中 | 收集纯净的气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
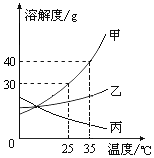 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 温度/℃ | 0 | 20 | 40 | 50 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 145 | 110 | 169 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③⑦ | C. | ②④⑦ | D. | ④⑤⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.| 编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| 1 | 20% | 锌粒 | 31.7 |
| 2 | 20% | 锌片 | 50.9 |
| 3 | 30% | 锌粒 | 61.7 |
| 4 | 30% | 锌片 | 79.9 |
| 时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com