
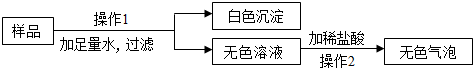
分析 把固体粉末加入水中,得到白色沉淀,根据题给的物质可以判断该白色沉淀为碳酸钙,得到的无色溶液与可以与稀盐酸反应生成无色气体,可以判断在无色溶液中含有碳酸钠,可以据此分析原固体粉末中一定含有碳酸钠,白色沉淀的产生可能是原有的,也可能是反应产生的进行组合即可.
解答 解:将白色粉末加入足量水后产生白色沉淀,可知该白色沉淀应该为碳酸钙,得到的无色溶液能够和稀盐酸反应生成气体,可以知道在固体粉末中一定含有碳酸钠,而白色沉淀碳酸钙可能是混合物中含有的,结合氧化钙可以和水反应生成氢氧化钙这一知识点,可以判断白色沉淀也可能是碳酸钠与氢氧化钙发生了反应而生成的,所以碳酸钙和氧化钙都为可能含有的物质;
(1)白色沉淀是碳酸钙,操作2完成后的溶液中一定含有的溶质是氯化钠,故填:CaCO3;NaCl;
(2)白色粉末的可能组合为:①碳酸钠,氧化钙; ②碳酸钠,碳酸钙; ③碳酸钠,氧化钙,碳酸钙等三种可能的组成.故有3种情况,故填:3;
(3)可以从放入盐酸后气泡产生的时间以及是否有气体生成的方面分析,重点是对放入物质量的角度讨论,如:加入盐酸后开始没有气泡,待一段时间后产生气泡;如果碳酸钠过量时,加入盐酸先与氢氧化钠反应,把氢氧化钠反应完再与碳酸钠反应,所以反应一段时间后再产生气泡(或没有气泡产生;如果碳酸钠没有过量时,加入盐酸后不会产生气泡或加入盐酸的量少,导致盐酸先和氢氧化钠反应没有气泡).故填:加入盐酸后开始没有气泡,待一段时间后产生气泡;如果碳酸钠过量时,加入盐酸先与氢氧化钠反应,把氢氧化钠反应完再与碳酸钠反应,所以反应一段时间后再产生气泡.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源:2017届山东省济宁市九年级中考模拟化学试卷(解析版) 题型:选择题
根据下面实验内容书写的化学方程式,正确的是( )
A.在空气中点燃镁条 Mg+O2 MgO
MgO
B.铝片放入稀硫酸中 Al+H2SO4═AlSO4+H2↑
C.氢氧化钠溶液中滴加氯化钡 2NaOH+BaCl2═Ba(OH)2↓+2NaCl
D.碳酸钠溶液中滴加硝酸银 Na2CO3+2AgNO3═Ag2CO3↓+2NaNO3
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 化工厂用氨、二氧化碳和水制碳酸氢铵:NH3+H2O+CO2=NH4HCO3 | |
| B. | 实验室用石灰石和稀盐酸反应制取二氧化碳:CaCO3+2HCl=CaCl2+CO2↑+H2O | |
| C. | 氯化铵与消石灰混合研磨产生氨气:2NH4C1+Ca(OH)2=CaCl2+2NH3↑+2H2O | |
| D. | 氢化钙(CaH2)与水反应可以得到氢气:CaH2+2H2O=Ca(OH)2+2H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
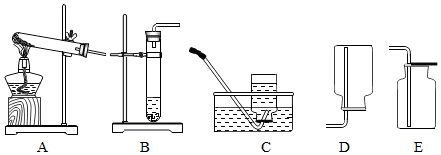
| 装置A | 装置B | |
| 反应状态 | 固体反应生成气体 | 固体和液体反应生成气体 |
| 反应条件 | 加热 | 无需加热 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com