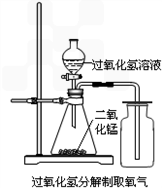
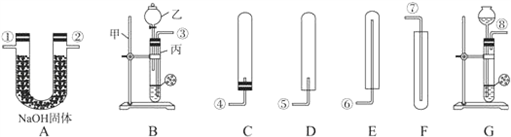
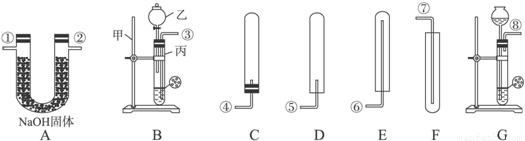
解:(1)实验室通常用稀盐酸与大理石反应制取二氧化碳,反应物的状态是固态和液态,反应条件是常温,应选固-液不加热型的发生装置;二氧化碳的密度比空气大,能溶于水,只能用向上排空气法收集;因为要收集到干燥的二氧化碳,所以应在收集装置前面加一个干燥装置,浓硫酸具有吸水性,可用来干燥二氧化碳,所以仪器的连接顺序为:A→E→F;碳酸钙和盐酸发生反应的化学方程式为 CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑.
(2)①过氧化氢以二氧化锰为催化剂生成水和氧气化学方程式为:2H
2O
2
2H
2O+O
2↑.
②浓硫酸具有吸水性,可以吸收二氧化碳中的水蒸汽.
③二氧化碳能使澄清的石灰水变浑浊.B装置增加的质量就是生成的二氧化碳的质量,二氧化碳中碳元素的质量=11g×

=3g.
④若将装置中的仪器E
2、B调换位置进行实验,石蜡燃烧后生成的水会在石灰水中凝结,使B装置的质量增大,E
2,装置质量减小,生成的水的质量减小,氢的质量就偏小.
故答案为:
(1)A→E→F;CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑.
(2)①2H
2O
2
2H
2O+O
2↑;②干燥作用;③3g,④偏小.
分析:(1)根据反应物的状态和反应条件确定实验室制取气体的发生装置,根据气体的密度和溶水性确定气体的收集装置,要得到干燥的二氧化碳,应在收集装置前面加一个干燥装置;熟记常用的化学方程式.
(2)①熟记过氧化氢分解的化学方程式.
②根据浓硫酸的性质进行分析.
③二氧化碳能和澄清的石灰水反应,仪器B增加的是二氧化碳的质量,根据二氧化碳的质量可求出二氧化碳中碳元素的质量.
④若将装置中的仪器E
2、B调换位置进行实验,石蜡燃烧后生成的水会在石灰水中凝结.
点评:二氧化碳和氢氧化钙、氢氧化钠都会发生反应,检验二氧化碳时一般用澄清的石灰水,因为二氧化碳和氢氧化钙反应有白色沉淀生成,而二氧化碳和氢氧化钠反应无明显现象;吸收二氧化碳时最好用氢氧化钠溶液,因为氢氧化钠极易溶于水,氢氧化钙微溶于水,等量的两种溶液中氢氧化钠溶液吸收的二氧化碳要多.


 2H2O+O2↑.
2H2O+O2↑. =3g.
=3g. 2H2O+O2↑;②干燥作用;③3g,④偏小.
2H2O+O2↑;②干燥作用;③3g,④偏小.

 名校课堂系列答案
名校课堂系列答案