
| A. | 大于7 | B. | 小于7 | C. | 等于7 | D. | 无法确定 |
分析 根据氢氧化钠、与盐酸反应的化学方程式,判断将溶质质量分数为10%的氢氧化钠溶液40g,与溶质质量分数为10%的盐酸溶液40g充分反应,反应后剩余的是哪一种溶液,再根据当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;进行分析判断.
解答 解:溶质质量分数为10%的氢氧化钠溶液40g,与溶质质量分数为10%的盐酸溶液40g,所含溶质的质量均为40g×10%=4g.
HCl+NaOH=NaCl+H2O
36.5 40
参加反应的盐酸与氢氧化钠的质量比为36.5:40,则所含溶质的质量均为4g的两种溶液混合充分反应后,盐酸有剩余,常温下反应后溶液的pH值小于7.
故选:B.
点评 本题难度不大,根据化学方程式的计算判断出反应后剩余的物质是正确解答本题的关键.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:初中化学 来源: 题型:选择题
| A. | 红磷在空气中燃烧,产生白色烟雾 | |
| B. | 镁条在空气中燃烧,放出热量,生成白色固体 | |
| C. | 铁丝在氧气中剧烈燃烧,火星四溅,放出热量,生成四氧化三铁 | |
| D. | 石蜡在空气中燃烧,发出蓝紫色火焰,产生有刺激性气味的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 过氧化氢是纯净物 | |
| B. | 过氧化氢的微观模型可表示为 | |
| C. | 过氧化氢是由两个氢原子和两个氧原子构成的 | |
| D. | 过氧化氢是由氢元素和氧元素组成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
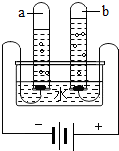 关于电解水实验的叙述正确的是( )
关于电解水实验的叙述正确的是( )| A. | 产生的H2和O2的质量比为2:1 | |
| B. | 实验说明水是由氢气和氧气组成的 | |
| C. | 水电解的化学方程式:2H2O=2H2↑+O2↑ | |
| D. | 试管a中的气体能燃烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
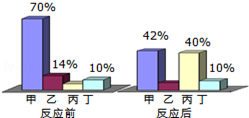
| A. | 丁是该反应的催化剂 | |
| B. | 甲、乙的质量之和一定等于生成丙的质量 | |
| C. | 该反应中甲、丙的质量比为7:9 | |
| D. | 该反应中乙、丙的质量比为3:17 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
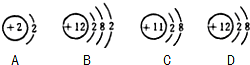
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com