
| A. | 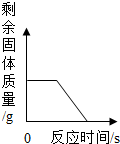 表示一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系 | |
| B. | 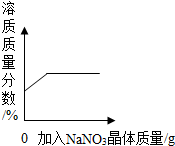 表示t℃时向饱和硝酸钠溶液中加入硝酸钠晶体,溶质质量分数与加入量的关系 | |
| C. | 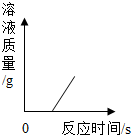 表示一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系 | |
| D. | 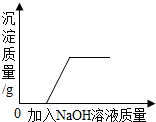 表示向盐酸和氯化铜混合溶液中加入氢氧化钠,沉淀质量与加入量的关系 |
分析 加热条件下,木炭和氧化铜反应生成铜和二氧化碳;
温度不变时,饱和溶液不能再溶解同种溶质;
稀硫酸和锌反应生成硫酸锌和氢气;
向盐酸和氯化铜混合溶液中加入氢氧化钠,氢氧化钠先和稀盐酸反应,后和氯化铜反应.
解答 解:A、加热条件下,木炭和氧化铜反应生成铜和二氧化碳,随着反应的进行,固体质量减小,但是不能减小到0,该选项不正确;
B、t℃时向饱和硝酸钠溶液中加入硝酸钠晶体,溶质质量分数不变,该选项不正确;
C、开始时溶液的质量即为稀硫酸的质量,不能是0,该选项不正确;
D、向盐酸和氯化铜混合溶液中加入氢氧化钠,氢氧化钠先和稀盐酸反应,后和氯化铜反应生成氢氧化铜沉淀,该选项正确.
故选:D.
点评 本题主要考查物质的性质,只有掌握了各种物质的性质,才能够判断物质之间相互转化时的反应物和生成物,从而可以进行各方面的判断.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
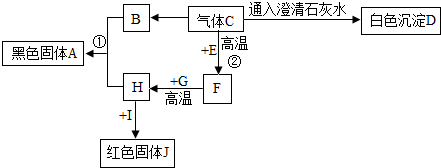
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 | |
| 乙同学 实验 | 取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管内的溶液中 | 铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色 | 乙同学 猜想成立 |
| 丙同学 实验 | 取中和反应后的溶液少许于试管中,向试管内滴加几滴无色酚酞试液 | 无色溶液变成红色 | 丙同学 猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
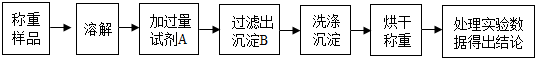
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH、BaCl2、Na2SO4 | B. | Na2CO3、NaCl、Na2SO4 | ||
| C. | CuSO4、NaCl、NaNO3 | D. | Na2SO4、HCl、NaNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com