现有硫酸钠和氢氧化钠的固体混合物(假设它们是混合均匀的),取部分样品进行分析实验:
(1)取2.62g固体混合物加水完全溶解后,加入氯化钡溶液至不再产生沉淀为止,过滤干燥后,称得沉淀的质量为2.33g.求2.62g固体混合物中硫酸钠的质量是多少?
(2)另取等质量的固体混合物溶于56.38g水后,再加入12g一定质量分数的稀硫酸,恰好完全反应,试计算反应后所得溶液中溶质的质量分数.
解:(1)设参与反应的硫酸钠的质量为x,
Na
2SO
4+BaCl
2=2NaCl+BaSO
4↓
142 233
x 2.33g
∴
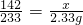
,
解之得:x=1.42g;
(2)2.62g固体混合物中氢氧化钠的质量为:2.62g-1.42g=1.2g;
设反应生成硫酸钠的质量为y,
2NaOH+H
2SO
4=Na
2SO
4+H
2O
80 142
1.2g y
∴
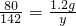
,
解之得:x=2.13g;
反应后所得溶液中溶质的质量分数为:

×100%=5%.
答:(1)2.62g固体混合物中硫酸钠的质量是1.42g;
(2)反应后所得溶液中溶质的质量分数为5%.
分析:(1)利用硫酸钠与氯化钡反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出2.62g固体混合物中硫酸钠的质量;
(2)根据(1)中计算出的2.62g固体混合物中硫酸钠的质量,就可计算出2.62g固体混合物中氢氧化钠的质量;然后利用氢氧化钠与硫酸反应的化学方程式和氢氧化钠的质量,列出比例式,就可计算出反应生成硫酸钠的质量;反应后所得溶液中溶质的质量=2.62g固体混合物中硫酸钠质量+反应生成硫酸钠的质量;反应后所得溶液质量=固体混合物质量+水的质量+稀硫酸质量,然后根据溶质质量分数=
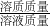
×100%计算即可.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

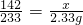 ,
,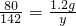 ,
, ×100%=5%.
×100%=5%.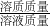 ×100%计算即可.
×100%计算即可.
