
| A. | 连二亚硫酸钠与水能剧烈反应,化学性质很活泼 | |
| B. | 连二亚硫酸钠是一种盐,硫元素化合价为+6价 | |
| C. | 连二亚硫酸钠俗称“保险粉”,原因是化学性质很稳定 | |
| D. | 连二亚硫酸钠俗称“保险粉”,无须密封保存 |
分析 A、根据连二亚硫酸钠与水能剧烈反应其化学性质很活泼进行解答;
B、根据盐的含义以及化合物中化合价的代数和为0进行解答;
C、根据连二亚硫酸钠的化学性质很活泼进行解答;
D、由题意,遇少量水或暴露在潮湿空气中易分解放热并引起燃烧,进行分析判断.
解答 解:A、连二亚硫酸钠与水能剧烈反应其化学性质很活泼,故正确;
B、连二亚硫酸钠是一种盐,硫元素化合价为+3价,故错误;
C、连二亚硫酸钠虽称为“保险粉”,但连二亚硫酸钠的化学性质很活泼,故错误;
D、连二亚硫酸钠(Na2S2O4)在遇少量水或暴露在潮湿空气中易分解放热并引起燃烧,说明该物质化学性质不稳定,应在干燥阴凉处密闭保存,故错误.
故选:A.
点评 解答本题的关键是要掌握各种物质的性质,只有掌握了物质的性质才能对物质的性质和储存方法做出正确的判断.


科目:初中化学 来源: 题型:解答题
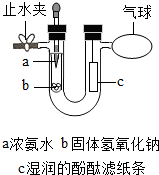 某同学在学完《分子和原子》后,对教材中的实验进行了如图改进:
某同学在学完《分子和原子》后,对教材中的实验进行了如图改进:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
| (1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有C |
| (2) | 取少量(1)所得上层溶液,加入过量的BaCl2溶液 | 有白色沉淀生成 | 燃烧产物中肯定有Na2CO3 |
| (3) | 取少量(2)所得上层清液,加入CuSO4(或CuCl2)溶液 | 有蓝色沉淀生成 | 燃烧产物中肯定有Na2O |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | pH=0和pH=9 | B. | pH=3和pH=4 | C. | pH=7和pH=14 | D. | pH=0和pH=7 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 我国化学家侯德榜于1923年研制成功的“联合制碱法(又称侯氏制碱法)”的主要特点是:在浓氨水(NH3极易溶于水)中通入足量的二氧化碳生成一种盐,然后在此溶液中加入细的食盐粉末,由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时由于大部分酸式碳酸盐加热容易转变为正盐,所以将析出的NaHCO3加热分解即可得纯碱,请回答:
我国化学家侯德榜于1923年研制成功的“联合制碱法(又称侯氏制碱法)”的主要特点是:在浓氨水(NH3极易溶于水)中通入足量的二氧化碳生成一种盐,然后在此溶液中加入细的食盐粉末,由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时由于大部分酸式碳酸盐加热容易转变为正盐,所以将析出的NaHCO3加热分解即可得纯碱,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某化学兴趣小组用如图燃烧红磷的方式做空气中氧气体积成分测定实验时,发现进入集气瓶内的水超过了$\frac{1}{5}$.全组人员为此纳闷,请问你能帮他们找出原因:燃烧匙伸入集气瓶时太慢、红磷燃烧时没有夹紧止水夹(至少找两点).
某化学兴趣小组用如图燃烧红磷的方式做空气中氧气体积成分测定实验时,发现进入集气瓶内的水超过了$\frac{1}{5}$.全组人员为此纳闷,请问你能帮他们找出原因:燃烧匙伸入集气瓶时太慢、红磷燃烧时没有夹紧止水夹(至少找两点).查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 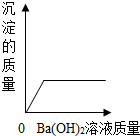 | B. | 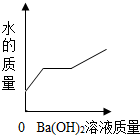 | C. |  | D. |  |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | 区分方法 | 现象 | 结论 |
| 例:①铜片和铁片 | 观察颜色 | 分别呈红色和银白色 | 呈红色的是铜片,呈银白色的是铁片 |
| ②白醋和白酒 | |||
| ③冰块和玻璃 | |||
| ④天然气和空气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com