
【题目】某科学兴趣小组的同学设计了如下四个实验装置(天平略)来验证质量守恒定律。
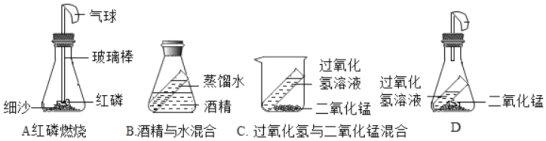
(1)上述的四个实验装置中_____装置能直接用于验证质量守恒定律;
(2)①装置A中发生反应的化学符号表达式:_____,实验过程中气球的变化是_____。
②点燃红磷的实验过程中,固体质量变化如图1所示:参加反应的氧气质量为_____g.
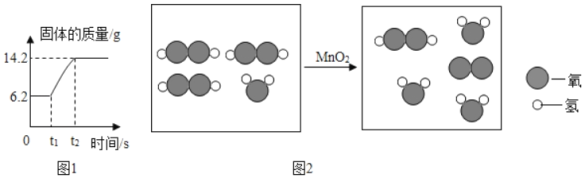
(3)C、D反应的微观示意图如图2所示,实际生成的物质分子数目之比为_____。
【答案】A、D 4P+5O2![]() 2P2O5 先变大后变瘪 8 2:1
2P2O5 先变大后变瘪 8 2:1
【解析】
(1)上述的四个实验装置,只有AD两个装置能直接用于验证质量守恒定律,另外两个装置被否定的原因分别是B装置内发生的变化属于物理变化,不能用质量守恒定律解释,C装置内产生的氧气会逸散到空气中,因此不能用来验证质量守恒定律。故填:A、D;
(2)①装置A为红磷燃烧生成五氧化二磷,发生反应的化学符号表达式4P+5O2![]() 2P2O5;实验过程中气球的变化是先变大后变瘪;
2P2O5;实验过程中气球的变化是先变大后变瘪;
②从图示看出,6.2g表示反应前固体的质量,就是红磷的质量,14.2g表示反应后固体的质量,是五氧化二磷的质量,则14.2g﹣6.2g=8g就表示参加反应的氧气的质量;
(3)过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为2H2O2![]() 2H2O+O2↑;可知实际生成的物质分子数目之比为2:1。
2H2O+O2↑;可知实际生成的物质分子数目之比为2:1。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】A、B、C、D、E是初中阶段常见物质,A、B、C、D分别是四种不同物质类别的化合物,E是导致温室效应的气体。它们存在如图所示的转化关系,“→”表示可以向箭头所指方向一步转化,“-”表示两种物质之间可以发生反应。请回答下列问题:

(1)写出E的化学式:______。
(2)写出B和D反应的化学方程式:______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲乙两物质的溶解度曲线如图所示,下列说法正确的是( )
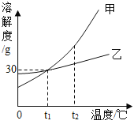
A. 甲物质的溶解度大于乙物质的溶解度
B. 甲物质饱和溶液从t2℃降温到t1℃,一定有晶体析出
C. t1℃时,甲和乙溶液的溶质质量分数一定相等
D. 当甲中混有少量乙时,可用蒸发结晶的方法提纯甲
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钠广泛用于造纸、纺织、制革等工业,是一种重要的化工原料。我国侯德榜发明了将制碱与制氨结合起来的联合制碱法,为碳酸钠的工业化生产作出了巨大贡献。
(查阅资料)侯氏制碱法中主要反应:
Ⅰ.NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
Ⅱ.2NaHCO3=Na2CO3+H2O+CO2↑
(实验探究)小明以粗盐配制饱和食盐水,并采用如图1所示装置模拟制备碳酸氢钠,进而制得碳酸钠。
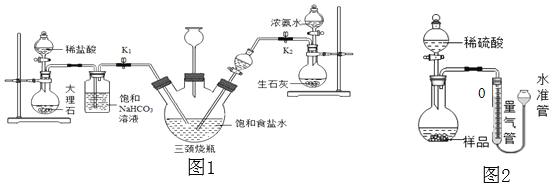
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。请回答下列问题:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
(1)粗盐中除了含有泥沙等不溶性杂质,还含有少量的MgCl2等。若要除去粗盐中的MgCl2,可加入过量的NaOH溶液,写出对应的化学方程式______,再过滤,然后向滤液中加入适量______,得到氯化钠溶液。
(2)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为______。
(3)三颈烧瓶上连接的长颈漏斗的主要作用是______,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______;关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是______。
(4)根据实验记录,计算t2时NaHCO3固体的分解率(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程_____。
(拓展延伸)小华设计如图2的实验装置测定某纯碱样品(含少量杂质NaCl)中碳酸钠的质量分数:取一定量的样品与足量稀硫酸反应,通过排饱和碳酸氢钠溶液测定生成CO2的体积,计算样品中碳酸钠的质量分数。(已知常温常压下CO2的密度是1.977g/L)
(1)如果样品质量为5.3g,则实验中选用的量气管规格最合适的是______(填字母)。
A.500mLB.1000mLC.1500mLD.2000mL
(2)若实验中测得碳酸钠质量分数偏小,下列可能的原因是______。
a.装置漏气
b.读取数据时量气管的液面低于水准管的液面
c.反应结束后烧瓶中有CO2残留
d.读取数据时仰视读数
e.稀硫酸加入烧瓶占据体积
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镓是一种放在手心就会熔化的金属,图①是镓元素在元素周期表中的信息;图②是镓原子的结构示意图,请回答:
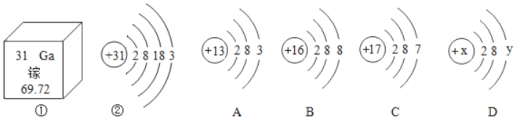
(1)镓原子位于元素周期表中第_____周期;
(2)A、B、C三种微粒所属元素中与镓元素化学性质相似的是_____(填“A”、“B”或“C”),则镓离子与B粒子形成的化合物的化学式为_____;
(3)镓和C形成的化合物是由_____(“分子”“原子”或“离子”)直接构成;
(4)D为某粒子的结构示意图,其中当x﹣y=8时,该粒子的符号为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜狮人类最早利用的金属之一。
(1)“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为______________。
利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件己略去):已知:
2Cu+2H2SO4+O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
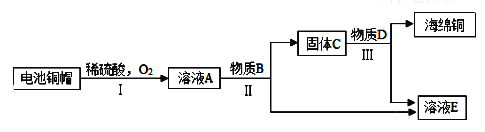
(2)①过程Ⅱ中分离操作的名称是______.
②过程Ⅲ中有气体产生,反应的化学方程式为______.
③A~E中含铜、锌两种元素的物质有______(填字母序号).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有 A、B、C 三种原子,已知 A 原子的核外第二层电子数等于第一层和第三层电子数之 和;B 原子的最外层电子数比次外层电子数多 4 个;C 原子的核电荷数比 A 原子的阴离子的核外电子数少6个。则:
(1)A原子的结构示意图为__________。
(2)B离子的结构示意图为__________。
(3)C原子的名称为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图表示的是甲、乙两种物质的溶解度曲线,据图所示,下列说法正确的是( )
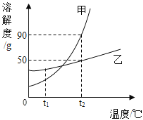
A. t2℃时,甲乙两物质饱和溶液中的溶质质量大小关系是甲>乙
B. 若甲物质中混有少量的乙物质,可以采用降温结晶的方法提纯甲物质
C. t2℃时将30g乙物质加入到50g水中,所得溶液的质量为80g
D. 将t1℃的甲、乙两物质的饱和溶液(均无固体物质剩余)升温到t2℃时,溶液中的溶质质量分数大小关系是甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com